题目内容
10.下列电离方程式正确的是( )| A. | CH3COOH=H++CH3COO- | B. | HClO?H++ClO- | ||
| C. | H2SO4 $\frac{\underline{\;通电\;}}{\;}$=2H++SO42- | D. | Ca(OH)2?Ca2++(OH-)2 |
分析 强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答.
解答 解:A、醋酸是弱电解质,在溶液中电离是可逆的,用可逆号,即为:CH3COOH?H++CH3COO-,故A错误;
B、次氯酸为弱酸,在溶液中部分电离,故用可逆号,即为HClO?H++ClO-,故B正确;
C、硫酸的电离是自发进行的,不需通电,故电离方程式为:H2SO4=2H++SO42-,故C错误;
D、氢氧化钙是强碱,电离是完全的,故用等号,且电离出一个钙离子和2个氢氧根离子,故电离方程式为:Ca(OH)2=Ca2++2OH-,故D错误.
故选B.
点评 本题考查了电离方程式的书写,明确电解质的强弱及电离方程式的书写规则是解本题关键,知道电解质电离出的阴阳离子分别是什么,注意原子团不能拆开.

练习册系列答案
相关题目
20.反应A+3B=2C+D在四种不同情况下的反应速率,其中最快的是( )
| A. | V(A)=0.15mol/(L•s) | B. | V(B)=0.6mol/(L•s) | C. | V(C)=0.5mol/(L•s) | D. | V(D)=0.45mol/(L•s) |
1.下列装置能达到实验目的是( )
| A. |  用于分离酒精和水 | |
| B. |  用于验证木炭与浓硫酸的反应产物中含有CO2 | |
| C. |  用于除去CO2中的少量HCl | |
| D. |  用于制备蒸馏水 |
18.食物按照其在体内代谢最终产物的性质,可分为酸性食物和碱性食物.属于碱性食物的是( )
| A. | 柠檬 | B. | 牛奶 | C. | 鸡肉 | D. | 糖果 |
5.有物质的量浓度均为0.1mol•L-1 的①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,下列说法正确的是( )
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是① | |
| C. | 若分别加入25mL 0.1mol•L-1盐酸后,pH最小的是② | |
| D. | 若升高温度,则③的pH不变 |
15.下列物质中,能使湿润的淀粉碘化钾试纸变蓝的是( )
| A. | 氯化钠溶液 | B. | 碘水 | C. | 新制盐酸 | D. | 溴化钠溶液 |
2.下列叙述错误的是( )
| A. | 用丁达尔现象区分溶液与胶体 | |
| B. | 用蒸馏的方法除去自来水中含有的Cl- | |
| C. | 用萃取的方法从某些植物中提取香料或中药成份 | |
| D. | 金属钠长期暴露在空气中的最终产物是NaHCO3 |
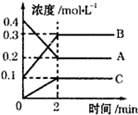 (1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1 2B+C.
2B+C.