题目内容
14. (1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-12CO (g)+O2(g)=2CO2(g);△H=-566.00kJ•mol-1
H2O(1)=H2O (g);△H=+44.00kJ•mol-1
试写出能表示CH3OH(1)燃烧热的热化学方程式:CH3OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(1)△H=-814.64kJ•mol-1.
试利用热化学方程式计算,完全燃烧16g甲醇生成CO2和H2O(l)时,放出的热量为407.32kJ
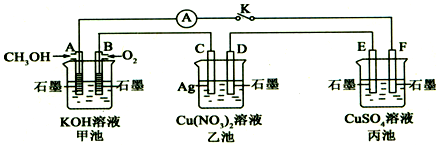
②科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池.据此回答下列问题:
氧气在正极;甲醇在负极
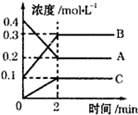
(2)如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题:
①该反应的方程式为2A
 2B+C.
2B+C.②2min内,用B表示的反应速率为0.1mol/(L•min).
③在其他条件下,测得A的反应速率为0.05mol/(L•s),此时的反应与800℃时相比,快.
分析 (1)①1molCH3OH(1)完全燃烧生成二氧化碳和液态水为燃烧热,结合盖斯定律、物质的量与反应中热量变化成正比计算;
②由甲醇和氧气以强碱做电解质溶液构成的原电池中,甲醇在负极上失去电子,氧气在正极上得到电子;
(2)①由图可知,A的物质的量浓度减少,B、C的物质的量浓度增加,则A为反应物、B、C为生成物,结合化学计量数之比等于浓度变化量之比计算;
②结合v=$\frac{△c}{△t}$计算;
③结合反应速率之比等于化学计量数之比计算A的反应速率,然后比较.
解答 解:①由a.CH3OH(1)+O2(g)=CO(g)+2H2O(g)△H=-443.64kJ•mol-1
b.2CO (g)+O2(g)=2CO2(g)△H=-566.00kJ•mol-1
c.H2O(1)=H2O (g)△H=+44.00kJ•mol-1
及1molCH3OH(1)完全燃烧生成二氧化碳和液态水为燃烧热可知,
a+b×$\frac{1}{2}$-c得到燃烧热的热化学方程式为CH3OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(1)△H=-814.64kJ•mol-1,
完全燃烧16g甲醇生成CO2和H2O(l)时,放出的热量为$\frac{16g}{32g/mol}$×814.64kJ=407.32kJ,
故答案为:CH3OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(1)△H=-814.64kJ•mol-1;407.32;
②由甲醇和氧气以强碱做电解质溶液构成的原电池中,甲醇在负极上失去电子,负极反应为CH3OH+8OH--6e-=CO32-+6H2O,氧气在正极上得到电子,
故答案为:正;负;
(2)①由图可知,A的物质的量浓度减少,B、C的物质的量浓度增加,则A为反应物、B、C为生成物,且△c(A):△c(B):△c(C)=2:2:1,2min时反应达到平衡,则反应方程式为2A 2B+C,
2B+C,
故答案为:2A 2B+C;
2B+C;
②2min内,用B表示的反应速率为$\frac{0.3mol/L-0.1mol/L}{2min}$=0.1mol/(L•min),故答案为:0.1mol/(L•min);
③反应速率之比等于化学计量数之比,则800℃时v(A)=v(B)=0.1mol/(L•min),可知在其他条件下,测得A的反应速率为0.05mol/(L•s)=3mol/(L•min),此时的反应与800℃时相比,比800℃时快,
故答案为:快.
点评 本题考查物质的量浓度随时间变化曲线、热化学反应及原电池,为高频考点,把握盖斯定律、燃烧热、原电池工作原理以及图中浓度变化、速率计算等为解答的关键,侧重分析与应用能力的考查,注意速率单位,题目难度不大.

①3,3-二甲基戊烷 ②2,3-二甲基-2-乙基丁烷
③3-乙基戊烷 ④2,5,5-三甲基己烷.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | 都错误 |
| A. | CH3COOH=H++CH3COO- | B. | HClO?H++ClO- | ||
| C. | H2SO4 $\frac{\underline{\;通电\;}}{\;}$=2H++SO42- | D. | Ca(OH)2?Ca2++(OH-)2 |
| A. | 升高温度 | B. | 减压 | C. | 加压 | D. | 适当降温 |
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是BD.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
| A. | Si与SiO2在常温下都可与NaOH溶液反应 | |
| B. | C与SiO2之间可以反应制备Si,同时得到CO | |
| C. | Si与SiO2都可以与氢氟酸反应 | |
| D. | Si→SiO2→H2SiO3可以通过一步反应实现 |
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 有些合金比纯净的金属耐腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |