题目内容
X、Y两元素的质子数之和为21,X原子的核外电子数比Y原子的核外电子数少5,则下列有关叙述中不正确的是( )
| A、X单质的固体是分子晶体 |
| B、Y单质能与某些金属氧化物反应 |
| C、Y单质能与酸反应,但不能与碱反应 |
| D、X、Y构成一种阴离子与硝酸反应可转化为Y的阳离子 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y两元素的质子数之和为21,设X的质子数是a,则Y质子数为21-a,X原子的核外电子数比Y原子的核外电子数少5,则(21-a)-a=5,则a=8,所以X是O元素、Y为Al元素,
A.根据晶体构成微粒确定晶体类型;
B.铝能和某些金属氧化物发生铝热反应;
C.Al和酸、强碱反应生成氢气;
D.偏铝酸根离子和过量酸反应生成铝离子.
A.根据晶体构成微粒确定晶体类型;
B.铝能和某些金属氧化物发生铝热反应;
C.Al和酸、强碱反应生成氢气;
D.偏铝酸根离子和过量酸反应生成铝离子.
解答:
解:X、Y两元素的质子数之和为21,设X的质子数是a,则Y质子数为21-a,X原子的核外电子数比Y原子的核外电子数少5,则(21-a)-a=5,则a=8,所以X是O元素、Y为Al元素,
A.X的单质为氧气或臭氧,都属于分子晶体,故A正确;
B.高温下,铝能和某些金属氧化物发生铝热反应而体现还原性,故B正确;
C.Al和酸、强碱反应生成氢气,2Al+6H+=2Al3++3H2↑、2OH-+2H2O+2Al=2AlO2-+3H2↑,故C错误;
D.偏铝酸根离子和过量硝酸反应生成铝离子,AlO2-+4H+=Al3++2H2O,故D正确;
故选C.
A.X的单质为氧气或臭氧,都属于分子晶体,故A正确;
B.高温下,铝能和某些金属氧化物发生铝热反应而体现还原性,故B正确;
C.Al和酸、强碱反应生成氢气,2Al+6H+=2Al3++3H2↑、2OH-+2H2O+2Al=2AlO2-+3H2↑,故C错误;
D.偏铝酸根离子和过量硝酸反应生成铝离子,AlO2-+4H+=Al3++2H2O,故D正确;
故选C.
点评:本题考查原子结构和元素周期律,明确原子结构、物质性质、晶体类型等知识点即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、IA族元素的金属性一定比ⅡA族元素的金属性强 |
| B、ⅥA族中氢化物最稳定的元素,其最高价含氧酸的酸性也最强 |
| C、某一元素可能既显金属性,又显非金属性 |
| D、短周期中,同周期元素所形成的简单离子的半径,从左到右逐渐减小 |
用下列装置进行相应实验,能达到实验目的是( )
A、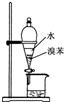 用如图所示装置分离出溴苯 |
B、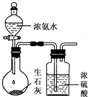 用如图所示装置制取干燥的氨气 |
C、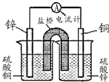 用如图设计成铜锌原电池装置 |
D、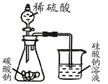 用如图证明氢化物稳定性SiH4>CH4>H2S |
下列关于胶体的说法中正确的是( )
| A、胶体外观不均匀 |
| B、胶体粒子能通过半透膜 |
| C、胶体不稳定,静置后容易产生沉淀 |
| D、胶体微粒做不停的无秩序运动 |
下列有机物命名正确的是( )
| A、2,4,4-三甲基戊烷 |
| B、2-乙基丁烷 |
| C、2,2,3,4-四甲基戊烷 |
| D、3,4,4-三甲基戊烷 |
某无色溶液能和Al反应放出H2,在该溶液中可能大量共存的离子组是( )
| A、Fe2+、NO3-、Cl-、H+ |
| B、Na+、OH-、NO3-、Cl- |
| C、Na+、SO42-、HCO3-、K+ |
| D、H+、SO42-、Cl-、Fe3+ |
苹果醋是一种由苹果发酵而成的食品.苹果酸( )是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
)是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
 )是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )
)是这种饮料的主要酸性物质.下列有关苹果酸性质的说法中,不正确的是( )| A、可以与NaHCO3溶液反应产生CO2 |
| B、可以与乙醇发生酯化反应 |
| C、1mol的苹果酸最多能与2mol金属钠反应 |
D、苹果酸与  互为同分异构体 互为同分异构体 |
根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A、M电子层电子数为奇数的所有元素都是金属 |
| B、第三、四、五、六周期元素的数目分别是8、18、32、32 |
| C、由左至右第2到12列,共十一列元素中没有非金属元素 |
| D、只有第ⅡA族元素的原子最外层有2个电子 |
下列关于常见有机化合物的说法中,不正确的是( )
| A、用溴水可鉴别苯与乙醇 |
| B、分子式为C5H12的有机物只有三种,它们互为同系物 |
| C、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键 |
| D、不能用KMnO4溶液除去乙烷中的乙烯 |