题目内容
对实验I-IV的实验现象预测错误的是( )
A、 继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
B、 实验试管中出现淡黄色浑浊 |
C、 实验中碳棒上有无色气泡产生 |
D、 实验中酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.在沸水中滴加饱和氯化铁溶液可生成氢氧化铁胶体;
B.发生二氧化硫与氯化铁的反应;
C.为原电池,Fe为负极,碳棒为正极,氢离子得电子;
D.实验中生成乙烯,能被高锰酸钾氧化.
B.发生二氧化硫与氯化铁的反应;
C.为原电池,Fe为负极,碳棒为正极,氢离子得电子;
D.实验中生成乙烯,能被高锰酸钾氧化.
解答:
解:A.在沸水中滴加饱和氯化铁溶液可生成氢氧化铁胶体,当光束通过体系时可产生丁达尔效应,故A正确;
B.试管中发生二氧化硫与氯化铁的反应,S元素的化合价升高,生成硫酸根离子,不会出现淡黄色沉淀,故B错误;
C.为原电池,Fe为负极,碳棒为正极,氢离子得电子,则碳棒上有无色气泡产生,故C正确;
D.生成乙烯,能被高锰酸钾氧化,则酸性KMnO4溶液中出现气泡且颜色逐渐褪去,故D正确.
故选B.
B.试管中发生二氧化硫与氯化铁的反应,S元素的化合价升高,生成硫酸根离子,不会出现淡黄色沉淀,故B错误;
C.为原电池,Fe为负极,碳棒为正极,氢离子得电子,则碳棒上有无色气泡产生,故C正确;
D.生成乙烯,能被高锰酸钾氧化,则酸性KMnO4溶液中出现气泡且颜色逐渐褪去,故D正确.
故选B.
点评:本题考查化学实验方案的评价,涉及原电池、乙烯的制取和性质、强酸制取弱酸、氧化还原反应等,侧重反应原理的考查,注意实验现象与原理的关系,题目难度中等.

练习册系列答案
相关题目
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.30×10-5mol/L.若在5mL含有KCl和KI浓度均为0.01mol/L的混合溶液中,滴加8mL 0.01mol/L的AgNO3溶液,则下列叙述中不正确的是A( )
| A、反应后溶液中离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B、发生反应生成的AgI沉淀多于AgCl沉淀 |
| C、在水中AgCl的溶解度比AgI的溶解度大 |
| D、若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
下列叙述正确的是.( )

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊既用于收集H2、CO2、Cl2和HCl气体,也可用于干燥H2、CO2、Cl2和HCl气体.

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊既用于收集H2、CO2、Cl2和HCl气体,也可用于干燥H2、CO2、Cl2和HCl气体.
| A、①⑤ | B、④⑤ | C、①② | D、③⑤ |
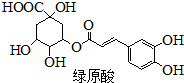 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A、奎尼酸分子式为C7H14O6 |
| B、绿原酸能发生取代、加成、消去和缩聚反应 |
| C、1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH |
| D、咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
下列化合物中所有原子或离子都满足最外层8电子或2电子结构的是( )
| A、乙硼烷B2H6 |
| B、氢化钠NaH |
| C、六氟化氙XeF6 |
| D、四氯化碳CCl4 |
在溶液中能大量共存的离子组是( )
| A、Na+、Mg2+、Cl-、SO42- |
| B、K+、NH4+、OH-、NO3- |
| C、Na+、Ca2+、CO32-、Cl- |
| D、Na+、H+、CO32-、SO42- |
 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.