题目内容
15.醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述不正确的是( )| A. | CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO?) | |
| B. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH=7 | |
| C. | CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动 | |
| D. | 室温下向pH=3的醋酸溶液中加水稀释,溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$不变 |
分析 A.醋酸中氢离子由醋酸和水电离,根据质子守恒分析;
B.常温下,pH=2的CH3COOH溶液中醋酸的浓度大于0.01mol/L,pH=12的NaOH溶液中NaOH的浓度为0.01mol/L;
C.根据同离子效应分析;
D.溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$=$\frac{1}{{K}_{h}}$,Kh只与温度有关.
解答 解:A.醋酸中氢离子由醋酸和水电离,根据质子守恒可知,c(H+)=c(OH-)+c(CH3COO?),故A正确;
B.常温下,pH=2的CH3COOH溶液中醋酸的浓度大于0.01mol/L,pH=12的NaOH溶液中NaOH的浓度为0.01mol/L,二者等体积混合,醋酸过量,混合后溶液显酸性,pH小于7,故B错误;
C.CH3COOH溶液中加入少量CH3COONa固体,醋酸根离子浓度增大,电离平衡逆向移动,故C正确;
D.室温下向pH=3的醋酸溶液中加水稀释,溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$=$\frac{1}{{K}_{h}}$,Kh为常数,所以温度不变,溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$不变,故D正确.
故选B.
点评 本题考查了弱电解质电离,明确影响平衡移动的因素即可解答,题目难度中等,注意把握影响水解常数的因素.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
16.铜是一种紫红色金属,被称作“电器工业的主角”铜主要是黄铜矿炼制,焙烧时发生反应2CuFeS2+O2$\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2,其简单流程如图所示,下列说法正确的是( )
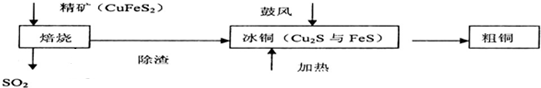

| A. | 焙烧时硫元素全部转化为二氧化硫 | B. | 在焙烧时氧化剂只有氧气 | ||
| C. | 粗铜精炼时用粗铜做阴极 | D. | Cu2S可用于火法炼制铜 |
7.已知 25℃时有关弱酸的电离平衡常数:则下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa) | |
| B. | 浓度均为0.2mol/L NaHCO3和 Na2CO3溶液中,存在的粒子种类不相同 | |
| C. | 0.4 mol•L-1HCN 溶液与 0.2 mol•L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=4且浓度均为0.1 mol•L-1的 CH3COOH、CH3COONa混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
4. 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )| A. | 醋酸的电离程度由大到小的顺序:b>c>a | |
| B. | 溶液的pH由大到小的顺序:a>c>b | |
| C. | 用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大 | |
| D. | 溶液中$\frac{{c(C{H_3}COOH)}}{{c(C{H_3}CO{O^-})}}$的数值不变 |
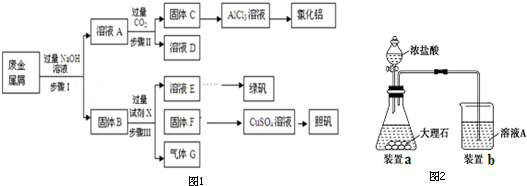
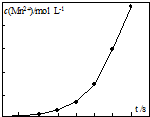 草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
草酸钠滴定法测定高锰酸钾的质量分数步骤如下: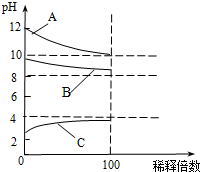 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH 在含有弱电解质的溶液中,往往有多个化学平衡共存
在含有弱电解质的溶液中,往往有多个化学平衡共存