题目内容
4.对某澄清透明溶液进行离子检验,实验结果如下,其中明显错误的是( )| A. | K+、Cu2+、Cl-、NO3- | B. | K+、Na+、OH-、CO32- | ||
| C. | Na+、Mg2+、Cl-、SO42- | D. | OH-、NO3-、Fe2+、Na+ |
分析 A.四种离子之间不反应,为澄清透明溶液;
B.四种离子之间不反应,能够共存;
C.四种离子之间不反应,可以存在于同一溶液中;
D.亚铁离子与氢氧根离子反应,不能共存.
解答 解:A.K+、Cu2+、Cl-、NO3-之间不发生反应,为澄清透明溶液,故A不选;
B.K+、Na+、OH-、CO32-之间不反应,能够大量共存,为澄清透明溶液,故B不选;
C.Na+、Mg2+、Cl-、SO42-之间不发生反应,为澄清透明溶液,故C不选;
D.OH-、Fe2+之间反应生成氢氧化亚铁,在溶液中不能大量共存,不属于澄清透明溶液,故D选;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl的分子所含中子数约为6.02×1023 | |
| C. | 3.5Cl2气体的体积约为22.4L | |
| D. | 35Cl2气体的摩尔质量为70 |
8.下列说法正确的是( )
| A. | 油脂属于天然高分子化合物,在碱性条件下水解可制得肥皂 | |
| B. | 在一定条件下,氨基酸之间能发生反应合成多肽 | |
| C. | 在淀粉水解液中加入氢氧化钠,再加入碘水,溶液未变蓝,说明淀粉己完全水解 | |
| D. | 蛋白质溶液中加入Na2SO4浓溶液有固体析出,加入足量水后固体不溶解 |
12.实验室里可按如图所示的装置干燥、储存气体 R,多余的气体可用水吸收,则 R是( )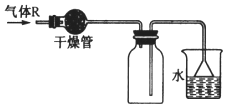

| A. | NO2 | B. | HCl | C. | SO2 | D. | NH3 |
19.已知(1)H2O(g)=H2O(l)△H1=-Q1 kJ•mol-1
(2)CH3OH(g)=CH3OH(l)△H2=-Q2 kJ•mol-1
(3)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H3=-Q3 kJ•mol-1
(Q1、Q2、Q3均大于0)若使1mol液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
(2)CH3OH(g)=CH3OH(l)△H2=-Q2 kJ•mol-1
(3)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H3=-Q3 kJ•mol-1
(Q1、Q2、Q3均大于0)若使1mol液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
| A. | Q1+Q2+Q3 | B. | 0.5Q3-Q2+2Q1 | C. | Q3-2Q2+4Q1 | D. | 0.5(Q1+Q2+Q3) |
9.化学与生活密切相关,下列说法错误的是( )
| A. | 食盐中加有碘,用其配成的溶液遇淀粉变蓝 | |
| B. | 厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大 | |
| C. | 使用氯气自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害 | |
| D. | 硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂. |
16.已知反应:
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
13.对于某些离子的检验及结论一定正确的是( )
| A. | 加入硝酸银溶液产生白色沉淀,一定有Cl- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 在100 g质量分数为30%的甲醛水溶液中,含有氢原子数为2NA | |
| B. | 7.8 g Na2S和Na2O2固体混合物中,含有的阴离子数为0.1NA | |
| C. | 1mol乙醇含有共价键的总数7NA | |
| D. | 反应2SO2(g)+O2(g)?2 SO3 (g),单位时间内消耗NA个O2分子的同时生成2NA个SO3分子,此时反应达到平衡状态 |