题目内容
19.既能跟硫酸反应又能跟NaOH溶液反应的化合物是( )| A. | Fe2O3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al |
分析 Al、氧化铝、氢氧化铝、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质都能和稀硫酸、NaOH反应,据此分析解答.
解答 解:A.氧化铁属于碱性氧化物,能和稀硫酸反应生成盐和水,和氢氧化钠不反应,故A错误;
B.碳酸氢钠属于弱酸酸式盐,能和稀硫酸、氢氧化钠反应,且属于化合物,故B正确;
C.碳酸钠属于弱酸强碱盐,能和稀硫酸反应但和氢氧化钠不反应,故C错误;
D.Al能和稀硫酸、氢氧化钠反应生成盐和氢气,但Al属于单质,不属于化合物,故D错误;
故选B.
点评 本题考查元素化合物性质,为高频考点,明确物质之间的转化是解本题关键,侧重考查学生分析判断能力,注意题干中要求“化合物”,为易错点.

练习册系列答案
相关题目
16.下列反应中,氧化剂与还原剂物质的量的关系不是1:2的是( )
| A. | 3S+6NaOH═Na2SO3+2Na2S+3H2O | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | 2FeCl2+Cl2=3FeCl3 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
10. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
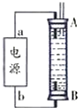
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
14.下列有关化学用语表示正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的比例模型 | ||
| C. | 原子核内有10个中子的氧原子:18O | D. | H2与H+互为同位素 |
4.下列有关化学用语表示正确的是( )
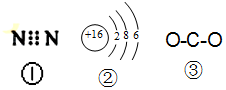

| A. | 图中的①是N2的电子式 | |
| B. | 图中的②是S2-的结构示意图 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | 图 ③为CO2的结构式 |
11. 燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.
燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.
请回答:
(1)含SO2的烟气未经处理直接排放的危害是ab(填字母).
a.危害人体健康 b.影响动植物生长
(2)SO2跟氨水反应生成NH4HSO3的化学方程式是SO2+NH3+H2O=NH4HSO3.
(3)②中通入空气发生反应时,NH4HSO3是b(填字母)
a.氧化剂 b.还原剂
(4)某研究小组对①产生的溶液进行监测,测得有关数据如下:
则c(HSO3-)=0.1mol/L.
 燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.
燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.请回答:
(1)含SO2的烟气未经处理直接排放的危害是ab(填字母).
a.危害人体健康 b.影响动植物生长
(2)SO2跟氨水反应生成NH4HSO3的化学方程式是SO2+NH3+H2O=NH4HSO3.
(3)②中通入空气发生反应时,NH4HSO3是b(填字母)
a.氧化剂 b.还原剂
(4)某研究小组对①产生的溶液进行监测,测得有关数据如下:
| 离子 | NH4+ | SO32- | HSO3- | SO42- |
| 浓度(mol/L) | 1.22 | 0.55 | 0.02 |
8.下列做法中符合可持续发展理念的是( )
| A. | 用“绿色化学”原理从源头上杜绝污染 | |
| B. | 废旧电池就地填埋 | |
| C. | 倡导使用铅蓄电池作动力的电动车 | |
| D. | 废旧塑料露天焚烧 |
9.离子方程式CO32-+2H+=CO2+H2O可表示的反应是( )
| A. | 可溶性碳酸盐与强酸反应生成CO2和H2O | |
| B. | 难溶的碳酸盐和难电离的酸反应生成CO2和H2O | |
| C. | 可溶性碳酸盐与任何酸溶液反应生成CO2和H2O | |
| D. | 石灰石和盐酸反应制取CO2 |