题目内容
4.下列有关化学用语表示正确的是( )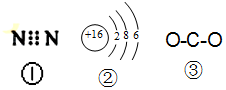
| A. | 图中的①是N2的电子式 | |
| B. | 图中的②是S2-的结构示意图 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | 图 ③为CO2的结构式 |
分析 A、氮气分子中存在氮氮三键,氮原子最外层为8电子;
B、硫离子的核外有18个电子;
C、质量数=质子数+中子数;
D、二氧化碳中碳原子和氧原子间为碳氧双键.
解答 解:A、氮气分子中存在氮氮三键,氮原子最外层为8电子,故N2的电子式为: ,故A错误;
,故A错误;
B、硫离子的核外有18个电子,故硫离子的结构示意图为 ,故B错误;
,故B错误;
C、质量数=质子数+中子数,故质子数为53、中子数为78的碘原子的质量数为131,故符号为13153I,故C正确;
D、二氧化碳中碳原子和氧原子间为碳氧双键,故二氧化碳的结构式为O=C=O,故D错误.
故选C.
点评 本题考查了常见的化学用语,难度不大,应注意的是在书写电子式之前先判断物质是共价化合物还是离子化合物.

练习册系列答案
相关题目
1.下列有关化学用语使用正确的是( )
| A. | 34S2-的结构示意图: | B. | H2O2的电子式: | ||
| C. | 甲烷分子的比例模型: | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
12.下列有关化学用语使用正确的是( )
| A. | S2-的结构示意图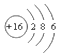 | B. | NH3结构式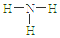 | C. | CO2的电子式: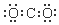 | D. | HCl电子式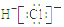 |
19.既能跟硫酸反应又能跟NaOH溶液反应的化合物是( )
| A. | Fe2O3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al |
9.三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB- (少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC.则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小是:A.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$c(CH3COOH) C.c(H+)•c(OH-)D.$\frac{c(O{H}^{-})}{({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$c(CH3COOH) C.c(H+)•c(OH-)D.$\frac{c(O{H}^{-})}{({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
16.进行化学实验时应强化安全和环保意识,下列做法正确的是( )
| A. | 制取氯气时为防止中毒应在露天的环境中进行 | |
| B. | 用试管加热碳酸氢钠固体时使试管口略向上倾斜 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 金属钠着火时应使用沙土盖灭 |
13.合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.下列物质不属于合金的是( )
| A. | 青铜 | B. | 水银 | C. | 硬铝 | D. | 碳素钢 |
14.实验室从碘水中提取碘,正确操作步骤是( )
| A. | 分液 蒸馏 | B. | 过滤 蒸发 | ||
| C. | 萃取 分液 | D. | 萃取 分液 蒸馏 |