题目内容
在下列给定的溶液中,一定能大量共存的离子组是( )
| A、过量Al与NaOH溶液反应所得溶液中:K+、Cl-、Al3+、SO42- | ||
| B、常温下,OH-的浓度为10-11mol/L的溶液中:Na+、I-、NH4+、NO3- | ||
C、常温下,
| ||
| D、与Al反应产生H2的溶液中:K+、Na+、Cl-、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.过量Al与NaOH溶液反应所得溶液,显碱性;
B.常温下,OH-的浓度为10-11mol/L的溶液,溶液显酸性;
C.常温下,
=0.1mol?L-1的溶液,溶液显酸性;
D.与Al反应产生H2的溶液,为非氧化性酸或强碱溶液.
B.常温下,OH-的浓度为10-11mol/L的溶液,溶液显酸性;
C.常温下,
| Kw |
| C(OH-) |
D.与Al反应产生H2的溶液,为非氧化性酸或强碱溶液.
解答:
解:A.过量Al与NaOH溶液反应所得溶液,显碱性,不能大量存在Al3+,故A错误;
B.常温下,OH-的浓度为10-11mol/L的溶液,溶液显酸性,H+、I-、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.常温下,
=0.1mol?L-1的溶液,溶液显酸性,该组离子之间不反应,可大量共存,故C正确;
D.与Al反应产生H2的溶液,为非氧化性酸或强碱溶液,酸性溶液中Al、NO3-发生氧化还原反应不生成氢气,故D错误;
故选C.
B.常温下,OH-的浓度为10-11mol/L的溶液,溶液显酸性,H+、I-、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.常温下,
| Kw |
| C(OH-) |
D.与Al反应产生H2的溶液,为非氧化性酸或强碱溶液,酸性溶液中Al、NO3-发生氧化还原反应不生成氢气,故D错误;
故选C.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ?mol-1
现有1g液态H2O,蒸发变成水蒸气时吸收的热量是( )
2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ?mol-1
现有1g液态H2O,蒸发变成水蒸气时吸收的热量是( )
| A、2.44 kJ |
| B、4.88 kJ |
| C、44.0 kJ |
| D、88.0 kJ |
某溶液只含有Na+、Fe3+、Cl-、SO42-四种离子,已知Na+、Fe3+、Cl-的个数比为3:2:1则溶液中Fe3+和SO42-离子的个数比为( )
| A、1:2 | B、1:4 |
| C、3:4 | D、3:2 |
有机物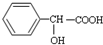 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )
 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )| A、6 种 |
| B、9 种 |
| C、15 种 |
| D、19 种 |
化学与日常生活密切相关,下列说法错误的是( )
| A、碘酒是指单质碘的乙醇溶液 |
| B、84消毒液的有效成分是NaClO |
| C、浓硫酸可刻蚀石英制艺术品 |
| D、装饰材料释放的甲醛会造成污染 |
 控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )
控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )| A、反应开始时,乙中石墨电极上发生氧化反应 |
| B、反应开始时,甲中石墨电极作负极 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、电流计读数为零后,在甲中溶入FeCl2,电流表可能会再次产生偏转 |
分析离子反应 xR2++yH++O2═mR3++nH2O,下列说法中正确的是( )
| A、n=2,H2O是氧化产物 |
| B、x=y=m=4 |
| C、该反应中R2+得到电子,被氧化为R3+ |
| D、任何氧化还原反应中氧化剂失电子总数都等于还原剂得电子总数 |
 纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.
纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.