题目内容
稀土元素是指元素周期表中原子序数为57 到71 的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素.稀土有“工业维生素”的美称,如今已成为极其重要的战略资源.
(1)钪(Sc)为21号元素,其基态原子M能层电子数为 .镝(Dy)的基态原子电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 .
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数据判断表中最有可能有+4价的元素是 .
几种稀土元素的电离能(单位:kJ?mol-1)
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有 .
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.ICH2CH2I中碳原子杂化轨道类型为 ,1mol CH2=CH2中含有的σ键数目为 .常温下,2-二碘乙烷为液体而乙烷为气体,其主要原因是 .
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有 个氧原子.
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为 ,列式表示Ce(铈)单质的密度: g?cm-3(不必计算出结果)
(1)钪(Sc)为21号元素,其基态原子M能层电子数为
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数据判断表中最有可能有+4价的元素是
几种稀土元素的电离能(单位:kJ?mol-1)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.ICH2CH2I中碳原子杂化轨道类型为
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)钪为21号元素,核外电子层排布为2、8、9、2,故M能层电子数为9;在f能级中有7个轨道,而镝的基态原子在f能级只排布了10个电子,故未成对电子数为4;
(2)第四电离能与第一电离能、第二电离能、第三电离能相差越小,第四个电子越容易失去,+4价的可能性越大,在上述表中Ce的I1+I2+I3和I4最接近,故应为Ce元素;
(3)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键.
(4)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键,故1mol CH2=CH2中含有的σ键数目为5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高,所以二碘乙烷在常温下为液体.
(5)在晶胞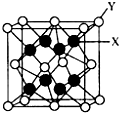 中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子.
中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子.
(6)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,这样的面有12个,晶胞中铈原子位于顶点和面心,数目为8×1/8+6×1/2=4,该晶胞体积为a3,该晶胞的质量为4M/NA,根据ρ=
可求得密度.
(2)第四电离能与第一电离能、第二电离能、第三电离能相差越小,第四个电子越容易失去,+4价的可能性越大,在上述表中Ce的I1+I2+I3和I4最接近,故应为Ce元素;
(3)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键.
(4)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键,故1mol CH2=CH2中含有的σ键数目为5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高,所以二碘乙烷在常温下为液体.
(5)在晶胞
 中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子.
中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子.(6)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,这样的面有12个,晶胞中铈原子位于顶点和面心,数目为8×1/8+6×1/2=4,该晶胞体积为a3,该晶胞的质量为4M/NA,根据ρ=
| m |
| V |
解答:
解:(1)钪为21号元素,核外电子层排布为2、8、9、2,故M能层电子数为9;在f能级中有7个轨道,而镝的基态原子在f能级只排布了10个电子,故未成对电子数为4,
故答案为:9;4;
(2)第四电离能与第一电离能、第二电离能、第三电离能相差越小,第四个电子越容易失去,+4价的可能性越大,在上述表中Ce的I1+I2+I3和I4最接近,故应为Ce元素,
故答案为:Ce;
(3)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键,故答案为:共价键和配位键;
(4)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键,故1mol CH2=CH2中含有的σ键数目为5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高,所以二碘乙烷在常温下为液体,
故答案为:sp3;5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高;
(5)在晶胞 中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子,
中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子,
故答案为:8;
(6)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,这样的面有12个,晶胞中铈原子位于顶点和面心,数目为8×1/8+6×1/2=4,该晶胞体积为a3,该晶胞的质量为4M/NA,根据ρ=
可知,密度为4M/NA×a3g?cm-3,即为
=
g?cm-3,
故答案为:12;
.
故答案为:9;4;
(2)第四电离能与第一电离能、第二电离能、第三电离能相差越小,第四个电子越容易失去,+4价的可能性越大,在上述表中Ce的I1+I2+I3和I4最接近,故应为Ce元素,
故答案为:Ce;
(3)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键,故答案为:共价键和配位键;
(4)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键,故1mol CH2=CH2中含有的σ键数目为5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高,所以二碘乙烷在常温下为液体,
故答案为:sp3;5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高;
(5)在晶胞
 中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子,
中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子,故答案为:8;
(6)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,这样的面有12个,晶胞中铈原子位于顶点和面心,数目为8×1/8+6×1/2=4,该晶胞体积为a3,该晶胞的质量为4M/NA,根据ρ=
| m |
| V |
| ||
| a3 |
| 4×140 |
| 6.02×1023×(516×10-10)3 |
故答案为:12;
| 4×140 |
| 6.02×1023×(516×10-10)3 |
点评:本题主要考查了核外电子排布、电离能、化学键、晶胞的结构和晶胞的计算等知识,中等难度,答题时注意物质结构的基础知识的灵活运用.

练习册系列答案
相关题目
下列有关石油化工的说法正确的是( )
| A、煤的干馏和石油的分馏均属化学变化 |
| B、汽油、煤油、柴油和植物油都是碳氢化合物 |
| C、石油的催化裂化的主要目的是获得汽油等轻质油 |
| D、石油分馏得到的汽油是纯净物 |
获2009年中国科技创业大赛最高奖的“超薄型软电池”的总反应为:Zn+2MnO2+2H2O═Zn(OH)2+2MnO(OH).下列说法正确的是( )
| A、该电池中Zn作负极,发生还原反应 |
| B、该电池工作时电流由Zn经导线流向MnO2 |
| C、该电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
| D、该电池工作时,若电路中转移2NA个电子(NA为阿伏加德罗常数),则负极质量减少约65g |
下列原子序数的元素,彼此之间能形成离子键的是( )
| A、1和16 | B、6和8 |
| C、9和11 | D、1和17 |
下列物质中,既有离子键又有共价键的是( )
| A、CaCl2 |
| B、KOH |
| C、H2O |
| D、HF |
元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( )
| A、XY2 |
| B、X2Y3 |
| C、X3Y2 |
| D、X2Y |
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期.D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料.则下列推断中不正确的是( )
| A、由A、C、D三种元素组成的化合物可以是离子化合物 |
| B、F与D形成的化合物熔点高,可以与某种酸反应 |
| C、原子半径由大到小的顺序是:E>F>C>D |
| D、五种元素中最高价氧化物对应的水化物酸性最强的是D |
从原子序数11依次增加到17,下列所叙递变关系错误的是( )
| A、最外层电子数逐渐增多 |
| B、原子半径逐渐增大 |
| C、最高正价数值逐渐增大 |
| D、从硅到氯负价从-4-1 |
 X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下: