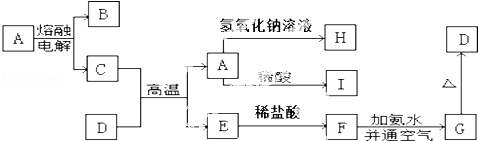
题目内容
6.高锰酸钾是一种典型的强氧化剂.完成下列填空I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①8MnO${\;}_{4}^{-}$+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O(已配平)
②MnO${\;}_{4}^{-}$+CuS+H+Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是d(填字母序号).
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下)SO2,转移电子的物质的量是0.8mol
d.还原性的强弱关系是:Mn2+>Cu2S.
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应.
(2)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2•6H2O(M=392g/mol)的质量为19.6g.需要的玻璃仪器有500mL容量瓶、烧杯、玻璃棒、胶头滴管
III:实验室可由软锰矿(主要成分为MnO2)制KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体.
请回答:
(4)用软锰矿制备K2MnO4的化学方程式是:6KOH+KClO3+3MnO2$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O.
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为1:2.
分析 (1)a.反应①中Mn元素的化合价降低,而铜元素的化合价由+1升到+2价,硫元素的化合价由-2升到+4价;
b.氧化剂为KMnO4,还原剂为Cu2S;
c.根据二氧化硫计算KMnO4的物质的量,结合Mn元素化合价变化计算转移电子;
d.还原剂的还原性强于还原产物的还原性;
(2)锰元素化合价由+7降到+2,化合价共降低5价,Fe元素化合价由+2升到+3,化合价共升高1价,化合价最小公倍数为5,再结合电荷守恒、原子守恒配平;
(3)没有480mL容量瓶,应选择500mL容量瓶,实际配置500mL,根据n=cV计算 Fe2+的物质的量,而n[(NH4)2Fe(SO4)2•6H2O]=n( Fe2+),再根据m=nM计算;
用固体溶解配置500mL一定物质的量浓度溶液,需要仪器有:500mL容量瓶、托盘天平、烧杯、玻璃棒、胶头滴管;
(4)高温下软锰矿(MnO2)与过量KOH(s)和KClO3(s)反应生成K2MnO4(锰酸钾)和KCl,由元素守恒可知,还有水生成;
(5)K2MnO4转化为KMnO4的反应中K2MnO4→2KMnO4+MnO2,Mn元素的化合价由+6价升高为+7价,Mn元素的化合价由+6价降低为+4价,K2MnO4既是氧化剂又是还原剂,根据电子转移守恒计算反应中氧化剂和还原剂的物质的量之比.
解答 解:(1)a.反应反应中,铜元素的化合价由+1升到+2价,硫元素的化合价由-2升到+4价,均被氧化,故a正确;
b.氧化剂为KMnO4,还原剂为Cu2S,由方程式可知,氧化剂与还原剂的物质的量之比为8:5,故b正确;
c.二氧化硫物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,由方程式可知消耗KMnO4为0.1mol×$\frac{8}{5}$=0.16mol,反应中Mn元素化合价由+7价降低为+2价,故转移电子为0.16mol×(7-2)=0.8 mol,故c正确;
d.还原剂的还原性大于还原产物的还原性,则还原性Cu2S>Mn2+,故d错误;
故答案为:d;
(2)锰元素化合价由+7降到+2,化合价共降低5价,Fe元素化合价由+2升到+3,化合价共升高1价,化合价最小公倍数为5,则MnO4-的系数为1、Fe2+的系数为5,故Mn2+的系数为1,Fe3+的系数为5,根据原子守恒可知H2O的系数为4,H+的系数为8,配平后离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:1,5,8,1,5,4;
(3)没有480mL容量瓶,应选择500mL容量瓶,实际配置500mL,n[(NH4)2Fe(SO4)2•6H2O]=n( Fe2+)=0.5L×0.1mol/L=0.05mol,故m[(NH4)2Fe(SO4)2•6H2O]=0.05mol×392g/mol=19.6g;
用固体溶解配置500mL一定物质的量浓度溶液,需要玻璃仪器有:500mL容量瓶、烧杯、玻璃棒、胶头滴管,
故答案为:19.6;500mL容量瓶、烧杯、玻璃棒、胶头滴管;
(4)高温下软锰矿(MnO2)与过量KOH(s)和KClO3(s)反应生成K2MnO4(锰酸钾)和KCl,由元素守恒可知,还有水生成,反应方程式为:6KOH+KClO3+3MnO2$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:6KOH+KClO3+3MnO2$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O;
(5)K2MnO4转化为KMnO4的反应中K2MnO4→2KMnO4+MnO2,Mn元素的化合价由+6价升高为+7价,Mn元素的化合价由+6价降低为+4价,K2MnO4既是氧化剂又是还原剂,根据电子转移守恒,反应中氧化剂和还原剂的物质的量之比为(7-6):(6-4)=1:2,
故答案为:1:2.
点评 本题是对氧化还原反应的综合考查,涉及氧化还原反应基本概念、氧化性及还原性比较、配平、计算以及溶液配制等,侧重分析与应用能力的考查,注意守恒法应用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 只要不加入其他物质,液氨中c(NH4+ )总是等于c(NH2- ) | |
| B. | 一定温度下,c(NH4+ )×c(NH2- )为常数 | |
| C. | 其他条件不变,增加液氨的量,电离平衡正向移动 | |
| D. | 维持温度不变,向液氨中加入少量氯化铵固体,c(NH2-)将减少 |
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
| A. | 0.1 s | B. | 2.5 s | C. | 5 s | D. | 10 s |
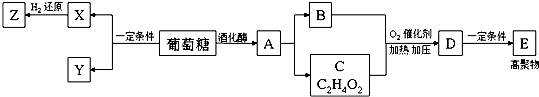
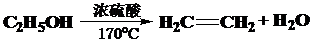 .
.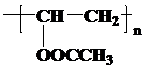 .
. .
. 已知X、Y和Z三种元素的原子序数之和等于48.X是有机物主要组成元素.X的一种1:1型气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子.
已知X、Y和Z三种元素的原子序数之和等于48.X是有机物主要组成元素.X的一种1:1型气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子.