题目内容
某化学兴趣小组在做《浓度对化学反应速率的影响》实验时发现,草酸溶液与高锰酸钾溶液反应时,溶液褪色先慢后快.为了探究此反应速率由小变大的原因,甲同学做了如下实验.
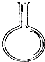
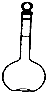
(1)0.10mol/L H2C2O4溶液的配制:实验室欲配制900mL 0.10mol/L H2C2O4 溶液,需要称取草酸晶
体(H2C2O4?2H2O g(精确到0.1g);实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管、量筒外
还有: .(填代号)
(2)反应速率变化的探究
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 .
②甲同学能够得出结论 .
(3)一定条件下,将2molNO与1molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体密度保持不变
c.每消耗1molO2同时消耗2molNO2 d.NO和O2的物质的量之比保持不变
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应
CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
①求CO的转化率 .
②平衡常数K= .
③若保持体积不变,再充入1.6molCO和0.8molCH3OH,此时v正 v逆(填“>”、“<”或“=”).
(1)0.10mol/L H2C2O4溶液的配制:实验室欲配制900mL 0.10mol/L H2C2O4 溶液,需要称取草酸晶
体(H2C2O4?2H2O
还有:
| A | B | C | D | E | F |
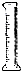 |
 |
 |
 |
 |
 |
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 |
2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体. |
| 褪色时间 | 31秒 | 4秒 |
②甲同学能够得出结论
(3)一定条件下,将2molNO与1molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体密度保持不变
c.每消耗1molO2同时消耗2molNO2 d.NO和O2的物质的量之比保持不变
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应
CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.8 | 1.0 | 0.2 |
②平衡常数K=
③若保持体积不变,再充入1.6molCO和0.8molCH3OH,此时v正
考点:配制一定物质的量浓度的溶液,化学平衡状态的判断,化学平衡的计算
专题:实验题,化学平衡专题
分析:(1)m=CVM计算草酸质量,根据各仪器的作用选取仪器;
(2)①高锰酸钾有强氧化性,能把草酸氧化成二氧化碳,同时自身被还原成锰离子;
②反应中生成锰离子,锰离子加快了反应速率,起到催化作用;
(3)a.随反应进行,气体的物质的量减小,压强减小;
b.混合气体密度始终保持不变,不能说明到达平衡状态;
c.随反应进行NO和O2的物质的量之比发生变化;
d.每消耗1molO2同时生成2molNO2,都表示正反应速率.
(4)①先求出一氧化碳的起始浓度,根据转化率的定义式计算;
②根据平衡常数k=
,将各物质的平衡浓度代入计算;
③计算浓度商,由浓度商与平衡常数的大小,判断平衡移动.
(2)①高锰酸钾有强氧化性,能把草酸氧化成二氧化碳,同时自身被还原成锰离子;
②反应中生成锰离子,锰离子加快了反应速率,起到催化作用;
(3)a.随反应进行,气体的物质的量减小,压强减小;
b.混合气体密度始终保持不变,不能说明到达平衡状态;
c.随反应进行NO和O2的物质的量之比发生变化;
d.每消耗1molO2同时生成2molNO2,都表示正反应速率.
(4)①先求出一氧化碳的起始浓度,根据转化率的定义式计算;
②根据平衡常数k=
| c(CH3OH) |
| c(CO)c2(H2) |
③计算浓度商,由浓度商与平衡常数的大小,判断平衡移动.
解答:
解:(1)m=CVM=0.10mol/L×0.9L×126g/mol=12.6g,实验中需要的仪器为:用于溶解晶体的烧杯,起搅拌和引流作用的玻璃棒,容量瓶没有900mL的,只能选择规格略大的1000mL容量瓶,定容时用的胶头滴管;
故答案为:12.6;1000mL容量瓶;
(2)①草酸和酸性高锰酸钾溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
②反应中生成锰离子,锰离子起到催化作用,加快了反应速率;故答案为:锰离子在反应中起到催化剂的作用,加快了反应速率;
(3)a.随反应进行,气体的物质的量减小,压强减小,体系压强保持不变,说明到达平衡状态,故a正确;
b.恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),混合气体密度始终保持不变,不能说明到达平衡状态,故b错误;
c.随反应进行NO和O2的物质的量之比发生变化,NO和O2的物质的量之比保持不变,说明到达平衡状态,故c正确;
d.每消耗1molO2同时生成2molNO2,都表示正反应速率,反应自始至终都按此比例进行,故d错误.
故选:ac.
(4)①
CO(g)+2H2(g)?CH3OH(g)
起始浓度/mol/L 1 1.4 0
转化浓度/mol/L 0.2 0.4 0.2
平衡浓度/mol/L 0.8 1 0.2
CO的转化率=
×100%=20%,故答案为:20%.
②平衡常数k=
=
=0.25 L2?moL-2.
故答案为;0.25 L2?moL-2.
③保持体积不变,再充入0.6molCO和0.8molCH3OH,此时c′(CO)=0.8mol/L+
=1.1mol/L,c(H2)=1mol/L,c′(CH3OH)=0.6mol/L+
=1mol/L,浓度商Qc=
=0.91>k,此时v正<v逆.
故答案为:<.
故答案为:12.6;1000mL容量瓶;
(2)①草酸和酸性高锰酸钾溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
②反应中生成锰离子,锰离子起到催化作用,加快了反应速率;故答案为:锰离子在反应中起到催化剂的作用,加快了反应速率;
(3)a.随反应进行,气体的物质的量减小,压强减小,体系压强保持不变,说明到达平衡状态,故a正确;
b.恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),混合气体密度始终保持不变,不能说明到达平衡状态,故b错误;
c.随反应进行NO和O2的物质的量之比发生变化,NO和O2的物质的量之比保持不变,说明到达平衡状态,故c正确;
d.每消耗1molO2同时生成2molNO2,都表示正反应速率,反应自始至终都按此比例进行,故d错误.
故选:ac.
(4)①
CO(g)+2H2(g)?CH3OH(g)
起始浓度/mol/L 1 1.4 0
转化浓度/mol/L 0.2 0.4 0.2
平衡浓度/mol/L 0.8 1 0.2
CO的转化率=
| 0.2 |
| 1 |
②平衡常数k=
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.2 |
| 0.8×12 |
故答案为;0.25 L2?moL-2.
③保持体积不变,再充入0.6molCO和0.8molCH3OH,此时c′(CO)=0.8mol/L+
| 0.6mol |
| 2L |
| 0.8mol |
| 2L |
| 1 |
| 1.1×12 |
故答案为:<.
点评:本题考查了探究外界条件对化学反应速率的影响,平衡状态判断、平衡常数与化学平衡计算等,难度中等.

练习册系列答案
相关题目
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离平衡常数,若已知下列反应可以发生:NaCN+HNO2═HCN+NaNO2,NaCN+HF═HCN+NaF,NaNO2+HF═HNO2+NaF,由此可判断下列叙述不正确的是( )
| A、K(HF)=7.2×10-4 |
| B、K(HCN)<K(HNO2)<K(HF) |
| C、根据①③两个反应即可知三种酸的相对强弱,相同条件下HCN的酸性最弱 |
| D、相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
除去括号内杂质所用试剂和方法,正确的是( )
| A、乙醇(乙酸):生石灰,过滤 |
| B、苯(苯酚):溴水,过滤 |
| C、乙酸乙酯(乙酸):氢氧化钠溶液,分液 |
| D、乙烷(乙烯):溴水,洗气 |
下列变化过程,氧元素发生了还原反应的是( )
| A、HgO→O2 |
| B、H2O2→O2 |
| C、CuO→H2O |
| D、H2O2→H2O |
在一盛有饱和Na2CO3溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后( )
| A、溶液的PH值增大;碳酸钠溶液的水解程度减小 |
| B、Na+和CO32-的浓度都减小 |
| C、阴极与阳极析出的气体物质的量之比为1:2 |
| D、溶液的浓度不变,有晶体析出 |