题目内容
2.(1)已知在光或热的作用下,由共轭二烯烃和一个亲双烯体发生1,4加成反应,生成环状化合物,如:
据此,请写出下列反应产物的结构简式:
CH2=CH-CH=CH2+CH2=CH-CHO
(2)已知烯烃能被酸性KMnO4溶液氧化,
 某烃的分子式为C6H10,用热的KMnO4溶液氧化后得到HOOCCH2CH2CH2CH2COOH,由此推断该烃的结构可能的结构简式:
某烃的分子式为C6H10,用热的KMnO4溶液氧化后得到HOOCCH2CH2CH2CH2COOH,由此推断该烃的结构可能的结构简式: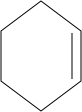 .
.
分析 (1)根据共轭二烯烃和一个亲双烯体发生1,4加成反应的特点写出新的产物;
(2)从信息得出,烯烃能被酸性KMnO4溶液氧化,碳碳双双键断开,有氢原子的碳被氧化成羧基,无氢原子的碳被氧化成羰基,从而分析出结构简式.
解答 解:(1)共轭二烯烃和一个亲双烯体发生1,4加成反应,生成环状化合物,共轭二烯烃中的碳双键都打开,在2,3号碳上重新组合成碳碳双键,另一个烯烃的碳碳双键打开与共轭二烯烃中的1,4号碳相连成环状,CH2=CH-CH=CH2+CH2=CH-CHO反应生成 ,故答案为:
,故答案为: ;
;
(2)烯烃能被酸性KMnO4溶液氧化,碳碳双双键断开,有氢原子的碳被氧化成羧基,无氢原子的碳被氧化成羰基,某烃的分子式为C6H10,用热的KMnO4溶液氧化后得到HOOCCH2CH2CH2CH2COOH,说明该烃是一个环烃,含碳碳双键,且碳碳双键的碳原子上都有氢原子,所以该烃的结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查了有机物官能团决定有机物的主要化学性质,抓住官能团的变化从而推断出产物的结构简式,在有机化学推断中,常常要用到顺向思维和逆向思维相结合,题目难度适中.

练习册系列答案
相关题目
12.下列反应属于吸热反应的是( )
| A. | Fe片与稀H2SO4的反应 | B. | Ba(OH)2•8H2O和NH4Cl反应 | ||
| C. | 盐酸和氢氧化钠的反应 | D. | 镁条在空气中的燃烧 |
13.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )
①a-b=m-n
②元素的原子序数b>a>d>c
③元素金属性X>Y
④最高价氧化物对应水化物的碱性Y>X.
①a-b=m-n
②元素的原子序数b>a>d>c
③元素金属性X>Y
④最高价氧化物对应水化物的碱性Y>X.
| A. | ②③ | B. | ③ | C. | ①④ | D. | ①②③ |
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.8gNa2O2固体中含离子总数为0.4NA | |
| B. | 2.0gH218O和D216O的混合物中所含中子数为NA | |
| C. | 常温下,22.4LCH4中含C-H共价键数为4NA | |
| D. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA |
7.下列叙述正确的是( )
| A. | S2-的结构示意图是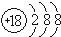 | B. | HCl 的电子式为H+[:Cl:]- | ||
| C. | H2O的结构式为H-O-H | D. | 还原性:HCl>H2S |
14.下列实验数据合理的是( )
| A. | 用托盘天平称取11.70g食盐 | |
| B. | 用量筒量取20.00mL未知浓度的盐酸注入锥形瓶 | |
| C. | 用标准NaOH溶液滴定未知浓度的盐酸,用去20.10mL NaOH溶液 | |
| D. | 用广泛pH试纸测某溶液的pH=3.5 |
11.用分液漏斗可以分离的一组液体混合物是( )
| A. | 硝基苯和水 | B. | 苯和溴苯 | C. | 汽油和苯 | D. | 溴和CCl4 |
12.25℃时某0.1mol/L的一元弱酸(用HA表示),未电离的弱酸分子(HA)的物质的量与电离生成的阴、阳离子总物质的量之比为4.5:1,则此溶液( )
| A. | 电离度α为10% | B. | α=20% | ||
| C. | pH=1 | D. | c(OH-)=1×10-12mol/L |

 .
.