题目内容
13.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )①a-b=m-n
②元素的原子序数b>a>d>c
③元素金属性X>Y
④最高价氧化物对应水化物的碱性Y>X.
| A. | ②③ | B. | ③ | C. | ①④ | D. | ①②③ |
分析 四种短周期元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,故原子序数大小顺序是:a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,在同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的金属性随着原子序数的增大而减小,元素的金属性越强,其最高价氧化物的水化物碱性越强,据此答题.
解答 解:四种短周期元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,故原子序数大小顺序是a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,
①离子aXm+、bYn+具有相同的电子层结构,则离子具有相同的电子数,即a-m=b-n,则a-b=m-n,故①正确;
②由题意可知,具有相同的电子层结构,根据阴前阳后,X、Y在下一周期,Z、R在上一周期,若m>n,则Y在X的前面,R在Z的前面,所以元素的原子序数为a>b>c>d,故②错误;
③X、Y为同一周期金属元素,在同一周期元素金属性从左向右逐渐减弱,即金属性:X<Y,故③错误;
④四种主族元素中X、Y为下一周期的金属元素,且元素的原子序数a>b,在同一周期元素的金属性从左向右在减弱,即金属性Y>X,则最高价氧化物对应水化物碱性Y>X,故④正确;
故选C.
点评 本题考查学生利用离子的电子层结构相同来分析元素的位置及性质,题目中等难度,答题时注意元素周期律的灵活运用,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | CS2分子中σ键与π键的数目之比是2:1 | |
| B. | 分子中含有非极性键,该分子一定是非极性分子 | |
| C. | NaOH是含有非极性共价键的离子化合物 | |
| D. | 在元素周期表中,d区和ds区的元素都是金属元素 |
4.下列说法不正确的是( )
| A. | 分子式为C3H8与C9H20的两种有机物一定互为同系物 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 分子组成相关一个或几个CH2原子团的化合物必定互为同系物 |
8.下列数值都是烃的相对分子质量,其对应的烃一定为烷烃的是( )
| A. | 54 | B. | 128 | C. | 42 | D. | 58 |
5.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3,其结构简式如图: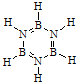 ,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
(1)与(HB=NH)3互为等电子体的分子为C6H6(填分子式).
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有4个硼原子,4个氮原子.
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷.工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物,该反应的化学方程式为3LiAlH4+4BF3$\frac{\underline{\;乙醚\;}}{\;}$2B2H6+3LiF+3AlF3.
(4)相关化学键的键能如表所示,简要分析和解释下列事实.
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,其原因为B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键.
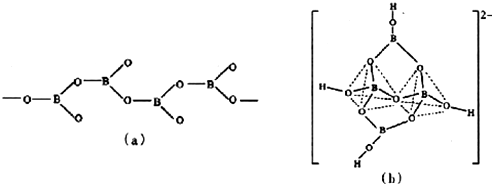
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多碰酸根,其化学式为BO2-;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型sp2、sp3.
 ,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:(1)与(HB=NH)3互为等电子体的分子为C6H6(填分子式).
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有4个硼原子,4个氮原子.
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷.工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物,该反应的化学方程式为3LiAlH4+4BF3$\frac{\underline{\;乙醚\;}}{\;}$2B2H6+3LiF+3AlF3.
(4)相关化学键的键能如表所示,简要分析和解释下列事实.
| 化学键 | B-H | B-O | B-B |
| 键能(KJ•mol-1) | 389 | 561 | 293 |
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多碰酸根,其化学式为BO2-;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型sp2、sp3.

 ,DE2的电子式
,DE2的电子式 .
.
 某烃的分子式为C6H10,用热的KMnO4溶液氧化后得到HOOCCH2CH2CH2CH2COOH,由此推断该烃的结构可能的结构简式:
某烃的分子式为C6H10,用热的KMnO4溶液氧化后得到HOOCCH2CH2CH2CH2COOH,由此推断该烃的结构可能的结构简式: .
.