题目内容
7.安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,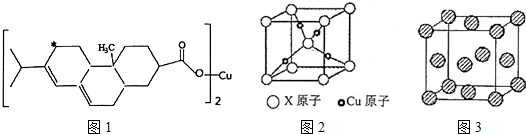
(1)请写出基态Cu原子的外围电子排布式3d104s1.焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了跃迁而变为激发态.
(2)新型农药松脂酸铜具有低残留的特点,图1是松脂酸铜的结构简式,请分析1个松脂酸铜中π键的个数6;加“*”碳原子的杂化方式为sp3.
(3)图2是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号);与X等距离且最近的X原子个数为8
(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型V形,比较第一电离能:S<O(填“>”或“<”)
(5)黄铜合金可以表示为Cu,Zn,为面心立方晶胞,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果):$\root{3}{\frac{257}{8.5N{\;}_{A}}}$cm.
分析 (1)Cu原子核外有29个电子,其3d、4s电子为其外围电子,基态铜原子在灼烧时外围电子发生了 跃迁吸收了一定波长的光,从而使灼烧的火焰呈绿色;
(2)松脂酸铜分子中碳碳双键和碳氧双键中都有π键,结合脂酸铜分子的结构简式计算π键的个数,加“*”碳原子周围有两个碳碳键和两个碳氢键,据此判断杂化方式;
(3)根据图2利用均摊法计算出X原子和铜原子数,进而确定化学式;根据晶胞图可知,以顶点X原子为例,与X等距离且最近的X原子位于晶胞的体心,据此答题;
(4)SO2分子中硫原子的价层电子对数为$\frac{6}{2}$=3,含有两个S-O键,一个孤电子对,据此判断几何构型,根据元素周期律,同主族元素从上向下第一电离能减小;
(5)为面心立方晶胞的物质的量为$\frac{1}{{N}_{A}}$,所以晶胞的体积为:$\frac{\frac{1}{{N}_{A}}×257}{8.5}$cm3,据此求晶胞的边长.
解答 解:(1)Cu原子核外电子数为29,根据能量最低原理,外围电子排布式为:3d104s1,基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色,
故答案为:3d104s1;跃迁;
(2)1个松脂酸铜中含有个双键,则含有6个π键,加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化,
故答案为:6;sp3;
(3)晶胞中Cu原子数目为4,X原子数目为1+8×$\frac{1}{8}$=2,故化学式为Cu2X,体心X原子与晶胞顶点的X原子距离为晶胞棱长的$\frac{\sqrt{3}}{2}$倍,而位于面心对角线X原子之间距离为棱长的$\sqrt{2}$倍,故体心X原子与晶胞顶点的X原子距离最近,X原子配位数为8,
故答案为:Cu2X;8;
(4)S原子孤对电子数为$\frac{6-2×2}{2}$=1、价层电子对数=2+1=3,故其空间结构为V形,同主族自上而下第一电离能减小,则第一电离能S<O,
故答案为:V形;<;
(5)为面心立方晶胞的物质的量为$\frac{1}{{N}_{A}}$,所以晶胞的体积为:$\frac{\frac{1}{{N}_{A}}×257}{8.5}$cm3,所以晶胞的边长为:$\root{3}{\frac{257}{8.5N{\;}_{A}}}$cm,故答案为:$\root{3}{\frac{257}{8.5N{\;}_{A}}}$cm.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞计算、电离能等,难度不大,掌握利用均摊法进行晶胞计算,注意同周期第一电离能异常情况.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | 分液、萃取、蒸馏?????????? | B. | 萃取、蒸馏、分液 | ||
| C. | 分液、蒸馏、萃取????????? | D. | 蒸馏、萃取、分液 |
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
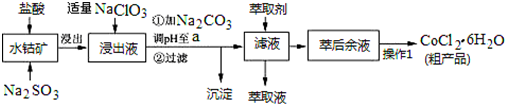
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
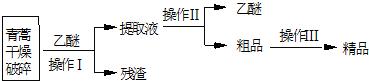
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:
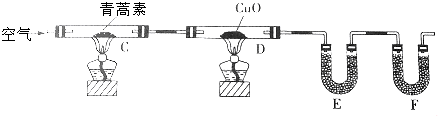
①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
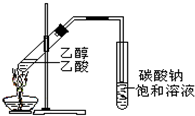 在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:

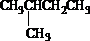
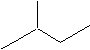

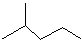
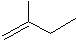
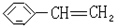 苯乙烯
苯乙烯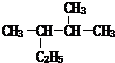 2,3-二甲基戊烷
2,3-二甲基戊烷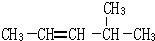 4-甲基-2戊烷
4-甲基-2戊烷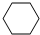 环己烷.
环己烷.