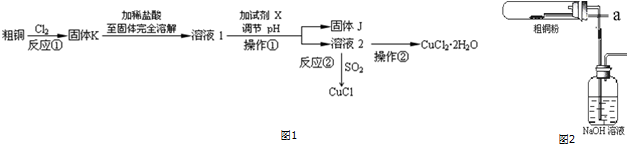
题目内容
2.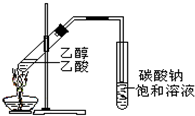 在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)浓硫酸的作用是:①催化剂;②吸水剂.
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止防倒吸.
(4)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是制得的乙酸乙酯中混有乙酸,该过程中发生反应的化学方程式是CH3COOH+NaHCO3-→CH3COONa+CO2+H2O.
分析 乙醇、乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,反应为可逆反应,浓硫酸起到催化剂、吸水剂的作用,生成的乙酸乙酯中混有乙酸、乙醇,可用饱和碳酸钠溶液吸收,以此解答该题.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂;吸水剂;
(3)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,故答案为:防倒吸;
(4)将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,说明生成二氧化碳,则制得的乙酸乙酯中混有乙酸,反应的方程式为CH3COOH+NaHCO3-→CH3COONa+CO2+H2O,
故答案为:制得的乙酸乙酯中混有乙酸;CH3COOH+NaHCO3-→CH3COONa+CO2+H2O.
点评 本题考查乙酸乙酯的制备,为高频考点,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力,难度不大.

练习册系列答案
相关题目
20.X、Y、Z、M是元素周期表中的短周期主族元素,且原子序数依次增大.X原子最外层电子数是内层电子数的2倍,Y、M同主族且M的核电荷数是Y的2倍,Z原子的半径在同周期主族元素原子中最大.下列有关说法正确的是( )
| A. | 气态氢化物的稳定性:X>Y | |
| B. | Y和M元素的最高正价相同 | |
| C. | X、Z分别与Y形成的化合物中,化学键类型相同 | |
| D. | Z的最高氧化物的水化物是强碱 |
1.已知a、b、c、d、e是短周期中原子序数依次增大的5种主族元素,其中元素a、e的单质在常温下呈气态,元素b的原子最外层电子数是其电子层数的2倍,元素c在同周期的主族元素中原子半径最大,元素d的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 原子半径:b<c<d | |
| B. | 金属性:d>c | |
| C. | 化合物ae与ce含有的化学键类型相同 | |
| D. | c、d的最高价氧化物对应的水化物之间能发生反应 |
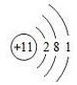 .
.
 .
.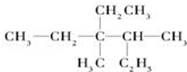 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷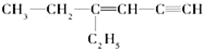 ,其中在同一平面上的碳原子至少为6个.
,其中在同一平面上的碳原子至少为6个. .
.