题目内容
在容积相同的甲、乙两个密闭容器中,分别充入1mol N2、3mol H2,使它们在温度相同的条件下反应,并达到平衡.若甲容器保持体积不变,乙容器保持压强不变,平衡时甲容器中N2的转化率为10%,则乙容器中N2的转化率为( )
| A、10% | B、大于10% |
| C、小于10% | D、5% |
考点:化学平衡的计算
专题:化学平衡专题
分析:在容积相同的甲、乙两个密闭容器中,分别充入1mol N2、3mol H2,使它们在温度相同的条件下反应,并达到平衡.若甲容器保持体积不变,平衡时甲容器中N2的转化率为10%,乙容器保持压强不变,反应是气体体积减小的反应,为保持恒压,体积减小压强增大,平衡正向进行,氮气的转化率增大;
解答:
解:在容积相同的甲、乙两个密闭容器中,分别充入1mol N2、3mol H2,使它们在温度相同的条件下反应,并达到平衡.若甲容器保持体积不变,平衡时甲容器中N2的转化率为10%,乙容器保持压强不变,反应是气体体积减小的反应,为保持恒压,体积减小压强增大,平衡正向进行,氮气的转化率增大,所以一容器中氮气的转化率大于10%;
故选B.
故选B.
点评:本题考查了化学平衡影响因素分析判断,恒温恒容,恒温恒压条件的平衡分析方法,掌握基础是关键,题目较简单.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
一定条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)?CH3OH(g),若开始时只充入a mol CH3OH蒸气,达到平衡时,混合物的压强比起始时增大了70%;若开始时充入a mol CO和2a mol H2的混合气体,达到平衡时H2的转化率为( )
| A、30% | B、35% |
| C、65% | D、70% |
下列叙述中,不正确的是( )
| A、天然气是以甲烷为主要成分的高效清洁燃料 |
| B、煤的干馏可得到煤焦油,通过煤焦油的分馏可获得各种芳香烃 |
| C、石油中含有烷烃和环烷烃,因此由石油不可能获得芳香烃 |
| D、通过石油的催化裂化及裂解可以得到轻质油和气态烯烃 |
下列关于离子反应及离子共存的说法中正确的是( )
| A、能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 |
| B、钢铁发生吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O |
| C、常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 |
| D、NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
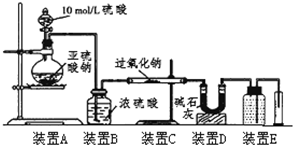 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.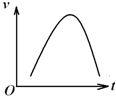 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.