题目内容
8.已知反应A+B═C+D的能量变化如图所示,下列说法正确的是( )
| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |
分析 A.反应条件与反应热之间没有必然关系;
B.根据图象中反应物总能量、生成物总能量大小分析;
C.结合图象可知,反应物总能量小于生成物总能量;
D.结合图象可知反应物总能量小于生成物总能量.
解答 解:A.某些吸热反应不需要加热也可以发生,如氢氧化钡晶体和铵盐发生的吸热反应,故A错误;
B.根据图象可知,该反应过程中反应物能量低于生成物能量,为吸热反应,故B正确;
C.该反应中,反应物能量低于生成物能量,为吸热反应,故C错误;
D.结合图象曲线变化可知,该反应中反应物总能量小于生成物总能量,故D错误;
故选B.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确反应热与反应物、生成物总能量的关系为解答关键,A为易错点,注意反应吸热放热和反应条件的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
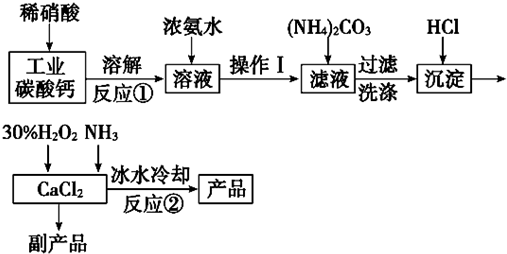
16.青蒿素是烃的含氧衍生物,为无色针状晶体.易溶于丙酮、氯仿和苯中,在水中几乎不溶,熔点为156-157℃.青蒿素是有效的抗疟药.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺为:
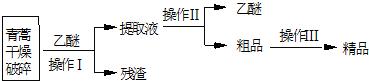
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:
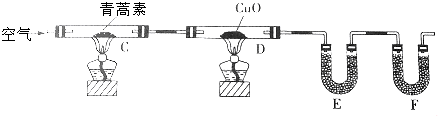
①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
青蒿素的最简式是15H22O5.
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:

①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
18.用下列实验装置和方法进行相应实验,能达到实验目的是( )
| A. | 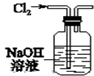 用图装置除去Cl2中混有的少量HCl | |
| B. | 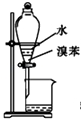 用图装置分离水和溴苯的混合物 | |
| C. | 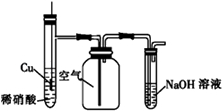 用图装置制备并收集NO气体 | |
| D. | 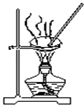 用图装置蒸干AlCl3饱和溶液制备AlCl3晶体 |
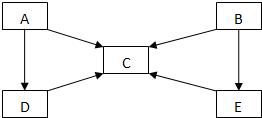 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示. .
.
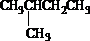

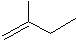
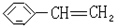 苯乙烯
苯乙烯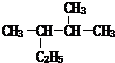 2,3-二甲基戊烷
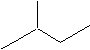
2,3-二甲基戊烷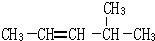 4-甲基-2戊烷
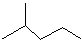
4-甲基-2戊烷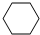 环己烷.
环己烷.