题目内容
15. 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:(1)氢氧燃料电池的能量转化主要形式是由化学能转变为电能,电极表面通入H(填H2或O2的电极为负极),该极的电极反应式为2H2+4OH--4e-═4H2O.
(2)该电池工作时,电解质溶液的密度减小,pH减小(填“增大”“减小”或“不变”).
(3)氢氧燃料电池电极反应产生的水,经冷凝后可作为人类的饮用水,当电池内有200mol电子转移时,可得到1.8L引用水(水的密度为1g/mL)
(4)将H2 改为CH4,其他均不变,则该极上的电极反应式为CH4+10OH-+8e-═CO32-+7H2O.
分析 (1)原电池是将化学能转变为电能的装置,负极是燃料发生氧化反应;碱性介质中电极产物不可能产生氢离子;
(2)由电解过程中生成水,所以电解质溶液的密度减小,氢氧化钾的浓度减小,所以溶液的PH值变小;
(3)xL水的质量为1000xg,其物质的量为$\frac{1000xg}{18g/mol}$,反应H元素化合价由0价升高为+1,故转移电子为$\frac{1000xg}{18g/mol}$×2=200,由此分析解答;
(4)将H2 改为CH4,其他均不变,甲烷发生氧化反应生成碳酸盐,该极上的电极反应式为CH4+10OH-+8e-═CO32-+7H2O.
解答 解:(1)原电池是将化学能转变为电能的装置,负极是燃料发生氧化反应,所以氢气是负极;极的电极反应式为 2H2+4OH--4e-═4H2O,故答案为:由化学能转变为电能、H2 2H2+4OH--4e-═4H2O(或H2+2OH--2e-═2H2O);
(2)由电解过程中生成水,所以电解质溶液的密度减小,氢氧化钾的浓度减小,所以溶液的PH值变小,故答案为:减小、减小;
(3)xL水的质量为1000xg,其物质的量为$\frac{1000xg}{18g/mol}$,反应H元素化合价由0价升高为+1,故转移电子为$\frac{1000xg}{18g/mol}$×2=200,解之得x=1.8,故答案为:1.8;
(4)将H2 改为CH4,其他均不变,甲烷发生氧化反应生成碳酸盐,该极上的电极反应式为CH4+10OH-+8e-═CO32-+7H2O,故答案为:CH4+10OH-+8e-═CO32-+7H2O.
点评 本题考查化学电源的工作原理,题目难度较大,注意原电池电极反应式的书写.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
6.为有效控制雾霾,各地积极采取措施改善大气质量.研究并有效控制空气中氮氧化物、碳氧化物含量显得尤为重要.
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:2NO(g)+O2(g)?2NO2(g),下列各项能说明该反应达到平衡状态的是abc.
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2,同时生成2molNO2
(2)在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)?2NO(g)的△H>0(填“>”或“<”).
(3)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图2:出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1.
Ⅱ.碳氧化物研究
(1)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图3所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO(g)+2H2(g)?CH3OH(g)
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
①根据上表数据,请比较T1>T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1=50%,该温度下的化学平衡常数为4.
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)<v (逆)(选填“>”、“<”或“=”),判断的理由是拔去铆钉,容器是在同温同压下进行,体积之比等于物质的量之比,当冲入6molCO,假设平衡不移动,此时容器的体积为6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆).
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}×1{0}^{-7}mol/L$(用含a和b的代数式表示)
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:2NO(g)+O2(g)?2NO2(g),下列各项能说明该反应达到平衡状态的是abc.
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2,同时生成2molNO2
(2)在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)?2NO(g)的△H>0(填“>”或“<”).

(3)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图2:出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1.
Ⅱ.碳氧化物研究
(1)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图3所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO(g)+2H2(g)?CH3OH(g)
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
| 10min | 20min | 30min | 40min | |
| T1 | 30% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)<v (逆)(选填“>”、“<”或“=”),判断的理由是拔去铆钉,容器是在同温同压下进行,体积之比等于物质的量之比,当冲入6molCO,假设平衡不移动,此时容器的体积为6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆).
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}×1{0}^{-7}mol/L$(用含a和b的代数式表示)
3.关于下列各装置图的叙述中,不正确的是( )
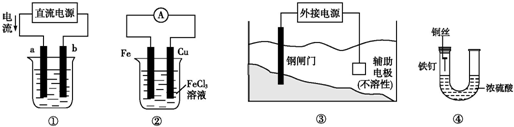

| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
10.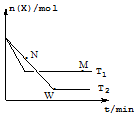 一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
 一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )| A. | △H<0 | |
| B. | 平衡时Z的产率:T2<T1 | |
| C. | M、N、W三点对应的混合气体的平均相对分子质量:W>M>N | |
| D. | M点的正反应速率大于N点的逆反应速率 |
7.化学反应4A(s)+3B(g)?2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1.对此反应速率的表示正确的是( )
| A. | 2 min内,用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值是1:1:1 | |
| C. | 2 min时间内反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 2 min内用C表示的反应速率v (C)是0.3 mol•L-1•min-1 |
4.在铜与浓硝酸反应的化学方程式中,没有生成的物质是( )
| A. | Cu(NO3)2 | B. | H2 | C. | NO2 | D. | H2O |
5.一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A. | 达到平衡时,X与Y 的浓度相等 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 若升高温度Y的转化率减小,则正反应为放热反应 |
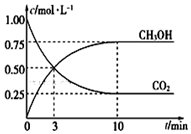 根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1
根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1