题目内容
5.一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )| A. | 达到平衡时,X与Y 的浓度相等 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 若升高温度Y的转化率减小,则正反应为放热反应 |
分析 经60s达到平衡,生成0.3mol Z,则
2X(g)+Y(g)?Z(g)
开始 1 1 0
转化 0.6 0.3 0.3
平衡 0.4 0.7 0.3
A.平衡时X、Y的物质的量不相等;
B.将容器体积变为20 L,压强减小,平衡逆向移动;
C.结合v=$\frac{△c}{△t}$计算;
D.升高温度Y的转化率减小,可知升高温度,平衡逆向移动.
解答 解:经60s达到平衡,生成0.3mol Z,则
2X(g)+Y(g)?Z(g)
开始 1 1 0
转化 0.6 0.3 0.3
平衡 0.4 0.7 0.3
A.平衡时X、Y的物质的量不相等,则二者浓度不等,故A错误;
B.将容器体积变为20 L,压强减小,平衡逆向移动,则Z的平衡浓度变小于原来的$\frac{1}{2}$,故C错误;
C.以X浓度变化表示的反应速率为$\frac{\frac{0.6mol}{10L}}{60s}$=0.001 mol/(L•s),故C错误;
D.升高温度Y的转化率减小,可知升高温度,平衡逆向移动,则正反应为放热反应,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、速率计算、平衡移动为解答的关键,侧重分析与计算能力的考查,注意选项B为解答的难点,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
16.下列离子能大量共存的是( )
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
13.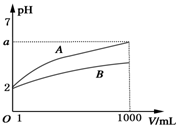 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )| A. | 稀释后A溶液的酸性比B溶液弱 | |
| B. | a=5时,A是强酸,B是弱酸 | |
| C. | 若A、B都是弱酸,则5>a>2 | |
| D. | A、B两种酸溶液物质的量浓度一定相等 |
10.硫酸工业尾气中的二氧化硫可用Na2SO3溶液吸收,将吸收液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )
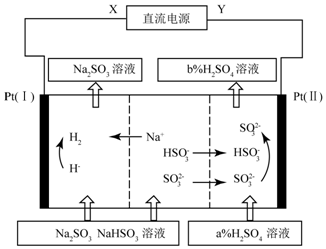

| A. | X为直流电源的正极,Y为直流电流的负极 | |
| B. | 图中的b<a | |
| C. | P(I)附近溶液的pH减小,Pt(II)附近溶液的pH增大 | |
| D. | 再生机理为:Pt(I)H+放电,导致“HSO3-?SO2-+H+”平衡右移 |
17.以下物质必须贮存在具有橡胶塞的玻璃试剂瓶中的是( )
①KOH溶液②Na2SiO3溶液③盐酸④氢氟酸⑤澄清石灰水⑥液溴⑦苏打溶液.
①KOH溶液②Na2SiO3溶液③盐酸④氢氟酸⑤澄清石灰水⑥液溴⑦苏打溶液.
| A. | ①⑤⑦ | B. | ①②⑤⑦ | C. | ①②④⑤⑦ | D. | ②③④⑥ |
14.下列有关石油及石油加工的说法中,正确的是( )
| A. | 石油是各种液态烃的混合物 | |
| B. | 常压分馏的原料是重油 | |
| C. | 由分馏塔分馏出的各馏分均是混合物 | |
| D. | 减压分馏的主要产品有汽油、润滑油、煤油和沥青 |
15.用下列实验装置完成对应的实验(部分仪器已省),能达到实验目的是( )
| A. | 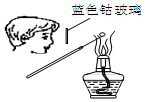 检验Na2CO3 中的Na+ | B. | 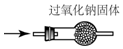 除去CO中混有的CO2 | ||
| C. | 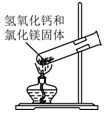 制取氨气 | D. | 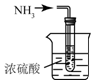 吸收氨气 |
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题: