题目内容
6.为有效控制雾霾,各地积极采取措施改善大气质量.研究并有效控制空气中氮氧化物、碳氧化物含量显得尤为重要.Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:2NO(g)+O2(g)?2NO2(g),下列各项能说明该反应达到平衡状态的是abc.
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2,同时生成2molNO2
(2)在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)?2NO(g)的△H>0(填“>”或“<”).

(3)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图2:出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1.
Ⅱ.碳氧化物研究
(1)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图3所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO(g)+2H2(g)?CH3OH(g)
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
| 10min | 20min | 30min | 40min | |
| T1 | 30% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)<v (逆)(选填“>”、“<”或“=”),判断的理由是拔去铆钉,容器是在同温同压下进行,体积之比等于物质的量之比,当冲入6molCO,假设平衡不移动,此时容器的体积为6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆).
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}×1{0}^{-7}mol/L$(用含a和b的代数式表示)
分析 Ⅰ(1)根据化学平衡时正逆反应速率相等,各组分含量保持不变分析选项;
(2)根据图象达到平衡的时间判断T1、T2的大小,再由平衡时的状态判断平衡移动方向;
(3)根据能量变化图计算反应热,反应焓变=反应物的键能和-生成物的键能和;
Ⅱ(1)①升高温度,化学反应速率加快,依此根据10min内,T2时CO转化率大于T1时判断温度的高低;
T2℃下,10min时CO转化率为35%,20min时CO转化率为50%,10-20min只转化15%,说明20min时已达平衡状态,依此判断第30min时CO转化率;列三段式计算K;
②根据浓度商和平衡常数的大小关系,判断反应进行的方向;
(2)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
解答 解:Ⅰ(1)恒容密闭容器中发生反应:2NO(g)+O2(g)?2NO2(g),
a.反应是个气体体积改变的反应,恒容容器,压强改变,平衡时,体系压强保持不变,故正确;
b.混合气体颜色保持不变,说明二氧化氮的浓度保持不变,达到平衡,故正确;
c.NO和O2的起始物质的量相等,但化学计量数不同,变化量就不相同,如果没有达到平衡,NO和O2 的物质的量之比会发生改变,不发生改变说明到达了平衡,故正确;
d. O2 是反应物,NO2是生成物,不管在任何时候都有每消耗1 molO2同时生成2 molNO2,故错误,
故选:abc;
(2)由图可知先达到平衡所用时间较短的温度较高,且此温度下氮气的体积分数较小,说明温度升高后,反应正向移动,故反应为吸热反应;
故答案为:>;
(3)该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+183 kJ•mol-1;
Ⅱ:(1)①升高温度,化学反应速率加快,10min内,T2时CO转化率大于T1时,故T2>T1;
T2℃下,10min时CO2转化率为35%,20min时CO2转化率为50%,10-20min只转化15%,说明20min时已达平衡状态,故第30min时,CO2转化率为50%;
T2℃下,CO(g)+2H2(g)═CH3OH(g),
起始(mol) 2 3 0
转化(mol) 1 2 1
\平衡(mol) 1 1 1
化学平衡常数K=$\frac{1mol÷2L}{(1mol÷2L)(1mol÷2L)^{2}}$=4;
故答案为:>;50%;4;
②拔去铆钉,容器是在同温同压下进行,体积之比等于物质的量之比,当冲入6molCO,假设平衡不移动,此时容器的体积为6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆);
故答案为:<;拔去铆钉,容器是在同温同压下进行,体积之比等于物质的量之比,当冲入6molCO,假设平衡不移动,此时容器的体积为6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆);
(2)反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}×1{0}^{-7}mol/L$;
故答案为:$\frac{2b}{a-2b}×1{0}^{-7}mol/L$.
点评 本题考查了键能与反应热的关系、化学反应速率影响因素及相关计算、化学平衡的移动原理、平衡常数的相关计算等知识,题目难度较大.

| A. | 2×10-7 mol/L | B. | 0.1×10-7 mol/L | C. | 0.5×10-7 mol/L | D. | 无法确定 |
| A. | 1L0.1mol•L-1的NaHSO4溶液中HSO4-总数为0.1NA | |
| B. | 16g16O2和18g18O2中含有的质子数均为8NA | |
| C. | 1molFe与足量的稀硝酸反应,转移电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水所得溶液中含有的氯离子数为0.1NA |
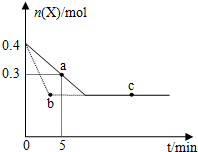
| A. | 虚线表示使用催化剂的情形 | |
| B. | b、c两点表明反应在相应条件下达到了最大限度 | |
| C. | 反应进行到a点时放出的热量大于反应进行到b点时放出的热量 | |
| D. | 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L•min) |
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8.
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4 起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度.
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
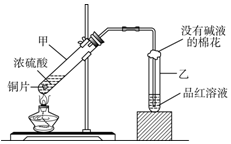 用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.
用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.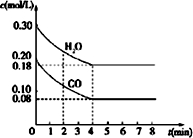 (1)已知在一定温度下,各反应的平衡常数如下:
(1)已知在一定温度下,各反应的平衡常数如下: 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: