题目内容
20. 根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1
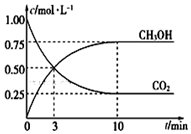
根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1一定温度下,在体积为1L的密闭容器中充入1.00mol CO2和3.00mol H2,测得CO2和CH3OH的浓度随时间变化如图所示.
①能说明该反应已达平衡状态的是A(填代号).
A.CO2在混合气体中的体积分数保持不变
B.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
C.反应中H2O与CH3OH的物质的量浓度比为1:1,且保持不变
②从反应开始到平衡时的平均反应速率v(H2)=0.225mol/(L.min),达到平衡时氢气的转化率为75%.
③该温度下的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$.
④下列的条件一定能加快反应速率并且提高H2转化率的是D(填代号).
A.降低反应温度 B.分离出水C.保持容器体积不变,充入稀有气体D.保持容器体积不变,充入CO2气体.
分析 ①可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
②由图可知,10min到达平衡,平衡时甲醇浓度变化量为0.75mol/L,根据方程式可知氢气浓度变化为0.75mol/L×3=2.25mol/L,根据v=$\frac{△c}{△t}$计算v(H2),根据△n=△c×V计算参加反应氢气物质的量,进而计算氢气转化率;
③化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
④升高温度、增大压强、增大物质浓度、使用催化剂可以加快反应速率,要提高H2转化率,应使平衡正向移动,但不能只增大氢气浓度,否则氢气转化率会降低.
解答 解:①A.平衡时各组分的含量保持不变,故CO2在混合气体中的体积分数保持不变,说明反应到达平衡,故A正确;
B.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O,均表示正反应速率,反应始终按该比例关系进行,不能说明到达平衡,应是“单位时间内每消耗1.2mol H2同时生成0.4mol H2O时,反应到达平衡”,故B错误;
C.反应中H2O与CH3OH的物质的量浓度比始终为1:1,不能说明到达平衡,故C错误,
故答案为:A;
②由图可知,10min到达平衡,平衡时甲醇浓度变化量为0.75mol/L,根据方程式可知氢气浓度变化为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L.min),参加反应氢气物质的量为2.25mol/L×1L=2.25mol,氢气转化率为$\frac{2.25mol}{3mol}$×100%=75%,
故答案为:0.225mol/(L.min);75%;
③CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)的化学平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
④A.降低反应温度,反应速率减慢,故A错误;
B.水为液体,分离出水,反应速率不变,不影响平衡移动,氢气转化率不变,故B错误;
C.保持容器体积不变,充入稀有气体,混合气体各组分浓度不变,反应速率不变、平衡不移动,氢气转化率不变,故C错误;
D.保持容器体积不变,充入CO2气体,二氧化碳浓度增大,反应速率加快,平衡正向移动,氢气转化率增大,故D正确,
故答案为:D.
点评 本题考查化学平衡计算与影响因素、反应速率计算及影响因素、平衡常数、反应热计算等,注意平衡常数表达式书写时,固体、纯液体不需要在化学平衡常数中写出.

| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Na+ |
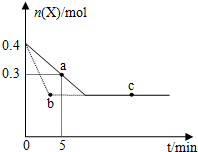
| A. | 虚线表示使用催化剂的情形 | |
| B. | b、c两点表明反应在相应条件下达到了最大限度 | |
| C. | 反应进行到a点时放出的热量大于反应进行到b点时放出的热量 | |
| D. | 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L•min) |
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向Na2S2O3溶液中滴入足量稀硫酸,溶液最终为无色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),气体颜色逐渐变浅 |
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系排列的组合中正确的是( )
a.体积:②>③b.密度:④>①c.质量:③>①d.氢原子个数:①>②
| A. | abc | B. | bcd | C. | abd | D. | abcd |
| A. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 | |
| D. | 常温条件下,在空气中铝不易被腐蚀 |
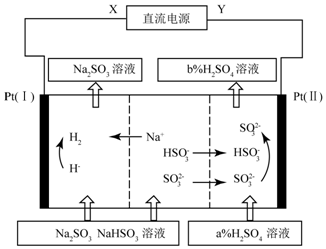
| A. | X为直流电源的正极,Y为直流电流的负极 | |
| B. | 图中的b<a | |
| C. | P(I)附近溶液的pH减小,Pt(II)附近溶液的pH增大 | |
| D. | 再生机理为:Pt(I)H+放电,导致“HSO3-?SO2-+H+”平衡右移 |
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
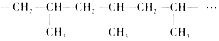 其重复结构单元即它的链节是
其重复结构单元即它的链节是 .
.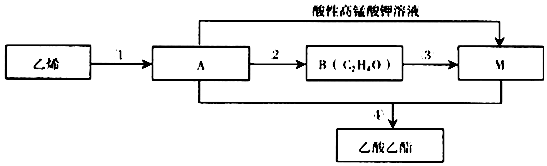
 ,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O. CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.
CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.