题目内容
9.配制100mL 1.0mol•L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )| A. | 容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 容量瓶内有少量水 | |
| D. | 用敞口容器称量NaOH且时间过长 |
分析 A.容量瓶润洗后,导致配制的溶液中溶质的物质的量偏大;
B.没有洗涤烧杯和玻璃杯,导致配制的溶液中溶质的物质的量偏小;
C.容量瓶中有少量水,不影响溶质的物质的量、最终溶液体积;
D.用敞口容器称量NaOH且时间过长,导致氢氧化钠变质,配制的溶液中氢氧化钠的物质的量偏小.
解答 解:A.容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗,配制的溶液中溶质的物质的量偏大,所得溶液浓度偏高,故A正确;
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,导致容量瓶中溶质的物质的量偏小,配制的溶液浓度偏低,故B错误;
C.容量瓶内有少量水,不影响溶质的物质的量和最终溶液体积,则不影响配制结果,故C错误;
D.用敞口容器称量NaOH且时间过长,氢氧化钠与空气中二氧化碳反应,则配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故D错误;
故选A.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,明确配制一定浓度的溶液方法为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
9.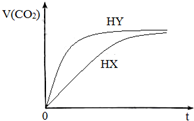 25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
 25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 用等浓度的两种酸恰好中和等浓度等体积的氢氧化钠溶液,前者所用的体积大于后者 | |
| B. | pH值相同的HX和HY溶液中水的电离程度:HX>HY | |
| C. | 相同体积相同浓度的NaX和NaY溶液中阴离子数目前者大于后者 | |
| D. | 向10mL 0.1mol/L的Na2CO3溶液中缓慢滴加10mL0.1mol/L的HY,混合后的离子浓度大小关系:c (Na+)>c (Y-)>c (HCO3-)>c (OH-)>c (H+) |
14.下列关于常见有机物的说法正确的是( )
| A. | 乙烯和甲苯都能与溴水、H2反应 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 甲苯既能使溴的水溶液褪色,又能在光照下与溴蒸气发生取代反应 | |
| D. | 可用酸性高锰酸钾溶液鉴别乙烯和甲烷或除去甲烷中的乙烯 |
18.可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )
①一个N-N断裂的同时,有3个H-H键断裂
②一个N-N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体系压强不再改变
⑤各物质的质量分数都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L•min,逆反应速率v(NH3)=0.4mol/L•min.
①一个N-N断裂的同时,有3个H-H键断裂
②一个N-N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体系压强不再改变
⑤各物质的质量分数都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L•min,逆反应速率v(NH3)=0.4mol/L•min.
| A. | 全部 | B. | 只有①③④⑤ | C. | ②③④⑤⑦ | D. | 只有①③⑤⑥⑦ |
19.在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
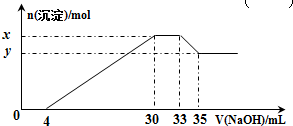

| A. | x与y的差值为0.1 mol | B. | 原溶液中c(Cl-)=0.75 mol•L-1 | ||
| C. | 原溶液的pH=1 | D. | 原溶液中n(Mg2+):n(Al3+)=5:2 |
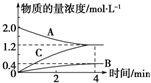 如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:
如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答: ;
;