题目内容
10.图中A、B均为固体,其中B为单质.图可用于工业生产F,F是衡量一个国家化工水平的标志.回答下列问题: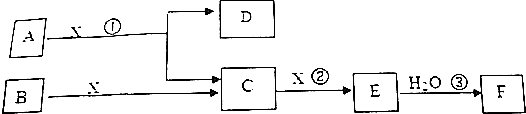
(1)A的化学式FeS2.
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子22mol.
(3)写出D与铝单质反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(4)写出气体C与氢氧化钠溶液反应的离子化学方程式SO2+2OH-=SO32-+H2O.
分析 F是衡量一个国家化工水平的标志,F应为H2SO4,由转化关系可知E为SO3,C为SO2,则X为O2,B为S,固体A用于工业生成硫酸,A为FeS2,D为Fe2O3,以此解答该题.
解答 解:F是衡量一个国家化工水平的标志,F应为H2SO4,由转化关系可知E为SO3,C为SO2,则X为O2,B为S,固体A用于工业生成硫酸,A为FeS2,D为Fe2O3,
(1)由以上分析可知A为FeS2,故答案为:FeS2;
(2)反应①是一个氧化还原反应,方程式为4FeS2+11O2=2Fe2O3+8SO2,该反应发生时,每生成4mol气体SO2,消耗5.5mol氧气,转移电子的物质的量为5.5mol×22mol,故答案为:22;
(3)D为Fe2O3,与铝发生铝热反应,方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(4)C为SO2,与氢氧化钠溶液反应的离子方程式为SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O.
点评 本题考查无机物的推断,为高考常见题型和高频考点,侧重于学生的分析能力以及元素化合价知识的综合理解和运用的考查,注意把握物质的性质、应用以及转化关系,难度不大.

练习册系列答案
相关题目
20.标准状况下有以下四种气体:①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3.下列关系不正确的是( )
| A. | 体积:④<①<③<② | B. | 质量:④<①<③<② | ||
| C. | 物质的量:①<②<③<④ | D. | 氢原子数:②<④<③<① |
18.下列叙述中,肯定甲金属比乙金属活泼性强的是( )
| A. | 甲原子的最外层电子数比乙原子的最外层电子数少 | |
| B. | 甲原子电子层数比乙原子的电子层数多 | |
| C. | 1mol 甲从酸中置换H+生成的H2比1 mol 乙从酸中置换H+生成的H2多 | |
| D. | 常温时,甲能从水中置换出氢,而乙不能 |
5.下列物质有颜色的是( )
| A. | 食盐溶液 | B. | 氯化钙溶液 | C. | 苏打水 | D. | 饱和氯水 |
5.下列卤代烃不能通过烯烃与相应卤化氢加成得到的是( )
| A. | CH3-CH2-Br | B. |  | ||
| C. |  | D. |  |
12.下列有机物常温下呈液态的是( )
| A. | CH3(CH2)2CH3 | B. | CH3(CH2)15CH3 | C. | CHCl3 | D. | CH3Cl |
9.配制100mL 1.0mol•L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )
| A. | 容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 容量瓶内有少量水 | |
| D. | 用敞口容器称量NaOH且时间过长 |
10.T℃时,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),发生反应:2SO2(g)+O2(g)?2SO3(g),5min时甲达到平衡.其起始量及SO2的平衡转化率如下表所示.下列叙述不正确的是( )
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,甲、丙中气体密度分别为ρ1、ρ2,则ρ2>2ρ1 | |
| D. | 平衡时,SO2的转化率:α1<80%<α2 |