题目内容
9.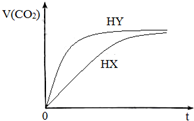 25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 用等浓度的两种酸恰好中和等浓度等体积的氢氧化钠溶液,前者所用的体积大于后者 | |
| B. | pH值相同的HX和HY溶液中水的电离程度:HX>HY | |
| C. | 相同体积相同浓度的NaX和NaY溶液中阴离子数目前者大于后者 | |
| D. | 向10mL 0.1mol/L的Na2CO3溶液中缓慢滴加10mL0.1mol/L的HY,混合后的离子浓度大小关系:c (Na+)>c (Y-)>c (HCO3-)>c (OH-)>c (H+) |
分析 HY与NaHCO3溶液反应速率快,溶液中氢离子浓度大,所以HY的酸性大于HX,则酸性的比较:HY>HX>H2CO3,NaHCO3水解促进水的电离,酸的酸性越强,对水的电离抑制程度越大,所以HY对水的抑制程度最大,则三种溶液中由水电离的c(OH-)大小:NaHCO3溶液>HX溶液>HY溶液,
A.酸性的比较:HY>HX,用等浓度的两种酸恰好中和等浓度等体积的氢氧化钠溶液,二者1:1发生酸碱中和反应;
B.pH值相同的HX和HY溶液中氢离子浓度相同,对水电离抑制程度相同;
C.酸性的比较:HY>HX,则NaX和NaY溶液水解程度NaX>NaY,电荷守恒分析判断阴离子数目大小;
D.酸性的比较:HY>HX>H2CO3,向10mL 0.1mol/L的Na2CO3溶液中缓慢滴加10mL0.1mol/L的HY,反应生成碳酸氢钠溶液和NaY溶液的混合物,Y-离子水解程度小于HCO3-,据此判断离子浓度大小.
解答 解:HY与NaHCO3溶液反应速率快,溶液中氢离子浓度大,所以HY的酸性大于HX,则酸性的比较:HY>HX>H2CO3,NaHCO3水解促进水的电离,酸的酸性越强,对水的电离抑制程度越大,所以HY对水的抑制程度最大,则三种溶液中由水电离的c(OH-)大小:NaHCO3溶液>HX溶液>HY溶液,
A.酸性的比较:HY>HX,用等浓度的两种酸恰好中和等浓度等体积的氢氧化钠溶液,二者1:1发生酸碱中和反应,所以所用的体积相同,故A错误;
B.pH值相同的HX和HY溶液中氢离子浓度相同,对水电离抑制程度相同,pH值相同的HX和HY溶液中水的电离程度:HX=HY,故B错误;
C.溶液中电荷守恒,c(Na+)+c(H+)=c(X-)+c(OH-),c(Na+)+c(H+)=c(Y-)+c(OH-),c(Na+)浓度相同,酸性的比较:HY>HX,则NaX和NaY溶液水解程度NaX>NaY,NaX溶液中氢氧根离子浓度大于NaY溶液中氢氧根离子浓度,则NaX溶液中氢离子浓度小于NaY溶液中氢离子浓度,相同体积相同浓度的NaX和NaY溶液中阴离子数目NaY大于NaX,故C错误;
D.酸性的比较:HX>HY>H2CO3,向10mL 0.1mol/L的Na2CO3溶液中缓慢滴加10mL0.1mol/L的HY,反应生成碳酸氢钠溶液和NaY溶液的混合物,Y-离子水解程度小于HCO3-,据此判断离子浓度大小c (Na+)>c (Y-)>c (HCO3-)>c (OH-)>c (H+),故D正确;
故选D.
点评 本题考查了弱电解质电离平衡影响因素、盐类水解程度大小比较、离子浓度大小比较、电解质溶液中电荷守恒等知识点,掌握基础是解题关键,题目难度中等.

| A. | 体积:④<①<③<② | B. | 质量:④<①<③<② | ||
| C. | 物质的量:①<②<③<④ | D. | 氢原子数:②<④<③<① |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 硫化氢气体通入氯化亚铁溶液:S2-+Fe2+═FeS↓ | |
| C. | 将氯气通入氯化亚铁溶液:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ |
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的 pH 降低,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗 0.1molO2则阳极理论上生成 0.2molCl2. |
①CH3(CH2)3CH3
②CH3(CH2)4CH3
③C(CH3)4
④(CH3)2CHCH2CH3.
| A. | ②①④③ | B. | ②③④① | C. | ③④①② | D. | ①④③② |
| A. | 甲原子的最外层电子数比乙原子的最外层电子数少 | |
| B. | 甲原子电子层数比乙原子的电子层数多 | |
| C. | 1mol 甲从酸中置换H+生成的H2比1 mol 乙从酸中置换H+生成的H2多 | |
| D. | 常温时,甲能从水中置换出氢,而乙不能 |
| A. | 容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 容量瓶内有少量水 | |
| D. | 用敞口容器称量NaOH且时间过长 |
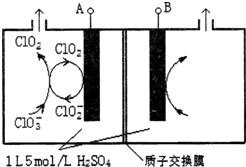 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.