题目内容
16.置换反应的通式可表示为: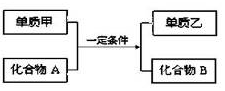
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若A为两种元素形成常温下呈液态的化合物,化合物B的焰色反应呈黄色.
则单质甲原子的原子结构示意图
 ,在这个反应中作氧化剂的是H2O(填化学式)
,在这个反应中作氧化剂的是H2O(填化学式)(2)若甲是一种金属单质,在高温条件下,本反应常用于焊接钢轨.请写出甲与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑,相同质量的甲分别与足量的氢氧化钠和盐酸反应,在相同条件下产生的气体体积比1:1
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物.请写出该反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
分析 (1)若A为两种元素形成常温下呈液态的化合物即H2O,化合物B的焰色反应呈黄色,则该反应为钠与水反应生成氢氧化钠与氢气;
(2)若甲是一种金属单质,在高温条件下,本反应常用于焊接钢轨,则为铝热反应,甲为Al;
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应为Mg在二氧化碳中燃烧生成MgO与碳.
解答 解:(1)若A为两种元素形成常温下呈液态的化合物即H2O,化合物B的焰色反应呈黄色,则该反应为钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,则单质甲为Na,钠的原子结构示意图为 ,作氧化剂的是H2O;故答案为:
,作氧化剂的是H2O;故答案为: ;H2O;
;H2O;
(2)若甲是一种金属单质,在高温条件下,本反应常用于焊接钢轨,则为铝热反应,甲为Al,所以甲与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,相同质量的甲分别与足量的氢氧化钠和盐酸反应,因为消耗的铝相同,所以转移电子数相同,则在相同条件下产生的气体体积比为1:1;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;1:1;
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应为Mg在二氧化碳中燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查无机物推断,需要学生熟练掌握元素化合物性质,难度中等,注意铝热反应的应用、镁在二氧化碳中的燃烧,在无机推断中经常考查.

练习册系列答案
相关题目
7.一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表.下对说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 | ||
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 | ||
| A. | 前 5 s 的平均反应速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 正反应是吸热反应 | |
| C. | 保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80% | |
| D. | 保持温度不变,起始时向容器中充入0.2molA、0.2molB?和1molC,反应达到平衡前v(正)<v(逆) |
4.下列由实验现象推出的结论正确的是( )
| A. | 向某溶液中加入CCl4,CCl4层显紫色,说明原溶液中存在I- | |
| B. | 某溶液中滴加NaOH生成白色沉淀,迅速变成灰绿色,最终变成红褐色,则原溶液有Fe2+,无Fe3+ | |
| C. | 将CO2通入某溶液中,不能产生白色沉淀,说明原溶液中不含Ba2+或Ca2+ | |
| D. | 用干净的铂丝蘸取某溶液在酒精灯外焰上灼烧,火焰呈黄色,说明该溶液中有Na+无K+ |
11.下列各物质相互混合进行反应,既有气体生成,最终又有白色沉淀生成的是( )
| A. | 金属钠投入CuSO4溶液中 | B. | 过量的NaOH溶液和明矾溶液反应 | ||
| C. | 金属钠投入MgSO4溶液中 | D. | 金属铝投入NaOH溶液中 |
1.化学版《青花瓷》中所描绘的“蓝色絮状的沉淀跃然试管底 铜离子遇氢氧根 再也不分离”、“无色酚酞面对碱 羞涩脸绯红 紫色石蕊遇到碱 青蓝慢淡出”等现象大家耳熟能详,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
8.配置一定物质的量浓度的NaCl溶液,不需要使用的仪器是( )
| A. | 烧杯 | B. | 容量瓶 | C. | 漏斗 | D. | 玻璃棒 |
5.常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种.已知A、B溶液中水的电离程度相同,A、C溶液的pH相同.下列说法中不正确的是( )
| A. | D溶液的pH=7 | |
| B. | 四种溶液相比,C溶液中水的电离程度最大 | |
| C. | A与C等体积混合后,溶液中有c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+) |
