题目内容
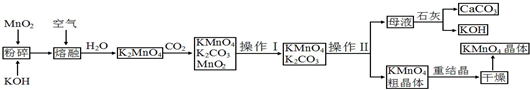
某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜.探究过程如下:(注:步骤⑤中操作乙为电解)

请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是 .该操作所需要的玻璃仪器有 .
(2)步骤②中,除发生反应Fe+2HCl═FeCl2+H2↑外,其他可能反应的离子方程式为: .
(3)步骤③中通入适量氯气的目的是 ,写出反应的离子方程式
(4)溶液C的颜色是 ,溶液D中可能含有的金属阳离子有 .
(5)可以验证溶液B中是否含有Fe2+的一种试剂是 (填选项序号)
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液.

请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是
(2)步骤②中,除发生反应Fe+2HCl═FeCl2+H2↑外,其他可能反应的离子方程式为:
(3)步骤③中通入适量氯气的目的是
(4)溶液C的颜色是
(5)可以验证溶液B中是否含有Fe2+的一种试剂是
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液.
考点:物质分离和提纯的方法和基本操作综合应用,性质实验方案的设计
专题:实验设计题
分析:废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,然后通入适量的氯气,
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液,以此解答.
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液,以此解答.
解答:
解:废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,然后通入适量的氯气,
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液;
(1)废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,所需要的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)固体A为Fe2O3和Fe的混合物,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,故答案为:Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+;
(3)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,所以通入适量氯气的目的是将溶液中的Fe2+氧化成Fe3+,故答案为:将溶液中的Fe2+氧化成Fe3+;2Fe2++Cl2=2Fe3++2Cl-;
(4)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,呈棕黄色,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,则溶液D中可能含有的金属阳离子有Fe2+、Cu2+、Fe3+,
故答案为:棕黄色;Fe2+、Cu2+、Fe3+;
(4)Fe2+具有还原性,可用酸性高锰酸钾溶液检验,发生氧化还原反应,酸性高锰酸钾溶液褪色,故答案为:d.
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液;
(1)废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,所需要的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)固体A为Fe2O3和Fe的混合物,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,故答案为:Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+;
(3)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,所以通入适量氯气的目的是将溶液中的Fe2+氧化成Fe3+,故答案为:将溶液中的Fe2+氧化成Fe3+;2Fe2++Cl2=2Fe3++2Cl-;
(4)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,呈棕黄色,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,则溶液D中可能含有的金属阳离子有Fe2+、Cu2+、Fe3+,
故答案为:棕黄色;Fe2+、Cu2+、Fe3+;
(4)Fe2+具有还原性,可用酸性高锰酸钾溶液检验,发生氧化还原反应,酸性高锰酸钾溶液褪色,故答案为:d.
点评:本题考查物质的分离、提纯和制备,综合考查学生的分析能力和实验能力,为高考常见题型,注意把握物质的性质以及物质分离的方法,难度中等.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
下列反应不属于氧化反应的是( )
| A、原电池的正极反应 |
| B、电解池的阳极反应 |
| C、金属的腐蚀 |
| D、煤的燃烧 |
已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能存在的离子组是( )
| A、Al3+、CH3COO-、Cl- |
| B、Mg2+、Ba2+、Br- |
| C、MnO4-、Na+、I-、 |
| D、Na+、NH4+、Cl- |
在相同温度时,100mL0.01mol?L-1的醋酸溶液与10mL 0.1mol?L-1的醋酸溶液相比较,下列数值或性质中,前者大于或强于后者的是( )
| A、H+的物质的量 |
| B、醋酸的电离常数 |
| C、中和时所需NaOH的量 |
| D、溶液的导电性 |
下列化学名词正确的是( )
| A、笨酚 | B、烧碱 |
| C、乙酸乙脂 | D、戍烷 |
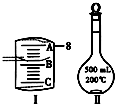 实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题: