题目内容
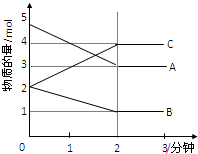 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).(1)该反应的化学方程式为
(2)反应开始至2分钟时,B的平均反应速率为
(3)由图求得A的平衡时的转化率为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(2)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(3)根据A达到平衡时已转化的物质的量与起始的物质的量之比,可求得转化率.
(2)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(3)根据A达到平衡时已转化的物质的量与起始的物质的量之比,可求得转化率.
解答:
解:(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B 2C,
2C,
故答案为:2A+B 2C;
2C;
(2)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为
=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(3)由图可知:达平衡时,△n(A)=2mol,所以A的转化率为
×100%=40%,故答案为:40%.
 2C,
2C,故答案为:2A+B
 2C;
2C;(2)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为
| 1mol |
| 5L?2min |
故答案为:0.1mol/(L.min);
(3)由图可知:达平衡时,△n(A)=2mol,所以A的转化率为
| 2mol |
| 5mol |
点评:本题考查化学实验及化学平衡图象问题,题目难度不大,注意把握由图象判断化学方程式的方法以及反应现象与结论的推断.

练习册系列答案
相关题目
X、Y均为短周期元素,其简单离子aXn-和bYm+电子层结构相同,则下列说法正确的是( )
| A、b-a=m+n |
| B、X的原子半径大于Y |
| C、X的族序数小于Y |
| D、X不可能是氢元素 |
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝.烤蓝时发生如下反应:
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O--Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH
下列说法中正确的是( )
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O--Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH
下列说法中正确的是( )
| A、Fe3O4可由铁在氧气中缓慢氧化得到 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |

 某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.

 甲醇合成反应及其能量变化如图所示:
甲醇合成反应及其能量变化如图所示: