题目内容
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝.烤蓝时发生如下反应:
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O--Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH
下列说法中正确的是( )
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O--Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH
下列说法中正确的是( )
| A、Fe3O4可由铁在氧气中缓慢氧化得到 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.铁在氧气中缓慢氧化得到Fe2O3;
B.根据电子守恒来分析;
C.反应③中各元素的化合价不变;
D.根据氧化剂氧化性大于氧化产物的氧化性判断.
B.根据电子守恒来分析;
C.反应③中各元素的化合价不变;
D.根据氧化剂氧化性大于氧化产物的氧化性判断.
解答:
解:A.由题意可知铁在碱性条件下反应生成Fe3O4,铁在氧气中缓慢氧化得到Fe2O3,故A错误;
B.Fe元素由+2升高为+3,N元素由+3降低为-3,由电子守恒及质量守恒定律可知反应为6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH,H2O的化学计量数为5,故B错误;
C.反应③中各元素的化合价不变,不属于氧化还原反应,故C错误;
D.氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,由此可判断碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强,故D正确.
故选D.
B.Fe元素由+2升高为+3,N元素由+3降低为-3,由电子守恒及质量守恒定律可知反应为6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH,H2O的化学计量数为5,故B错误;
C.反应③中各元素的化合价不变,不属于氧化还原反应,故C错误;
D.氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,由此可判断碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强,故D正确.
故选D.
点评:本题考查氧化还原反应,注意利用元素的化合价及相关信息来解答,明确元素的化合价变化是解答的关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
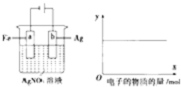 按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的质量.
| A、①③ | B、③④ |
| C、①②④ | D、①②⑤ |
在密闭容器中进行反应:2A+3B?2C.开始时C的浓度为a mol?L-1,2min后C的浓度变为2a mol?L-1,A和B的物质的量浓度均变为原来的
,则下列说法中不正确的是( )
| 1 |
| 2 |
| A、用B表示的反应速率是0.75a mol/(L?min) |
| B、反应开始时,c(B)=3a mol?L-1 |
| C、反应2min后,c(A)=0.5a mol?L-1 |
| D、反应2min后,c(B)=1.5a mol?L-1 |
下列变化过程中不能直接实现的是( )
①HCl ②Cl2 ③O2 ④HClO ⑤CO2.
①HCl ②Cl2 ③O2 ④HClO ⑤CO2.
| A、①→② | B、②→④ |
| C、④→③ | D、④→⑤ |
一般火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述中正确的是( )
| A、分子中碳原子在同一条直线上 |
| B、光照下能够发生取代反应 |
| C、比丁烷更易液化 |
| D、丙烷有两种同分异构体 |
下列化合物属于苯的同系物的是( )
A、 |
B、 |
C、 |
D、 |
下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )
A、 |
B、 |
C、 |
D、 |
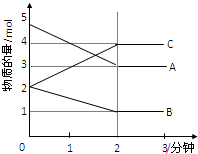 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体). 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: