题目内容
 甲醇合成反应及其能量变化如图所示:
甲醇合成反应及其能量变化如图所示:(1)写出合成甲醇的热化学方程式
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)在500℃达到平衡时,平衡常数K=
(4)在另一体积不变的密闭容器中,充入1.6mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为
(5)美国科学家成功开发便携式固体氧化物燃料电池,该燃料电池中一极通入空气,另一极通入甲醇气体,电解质是固态氧化物,在熔融状态下能传导O2-.在电路中每流过30mol电子,有
考点:热化学方程式,化学电源新型电池,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)依据图象分析,反应物的能量高于生成物,反应是放热,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的热量计算得到,依据热化学方程式的书写方法写出;
(2)依据化学反应速率的概念计算,化学反应速率等于单位时间内物质浓度的变化计算得到,计算甲醇的反应速率,依据速率之比等于化学方程式系数之比;
(3)依据图表数据依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(4)依据化学平衡三段式列式计算;
(5)该燃料电池中,燃料失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂的电极为正极,根据总反应,即分析得答案.
(2)依据化学反应速率的概念计算,化学反应速率等于单位时间内物质浓度的变化计算得到,计算甲醇的反应速率,依据速率之比等于化学方程式系数之比;
(3)依据图表数据依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(4)依据化学平衡三段式列式计算;
(5)该燃料电池中,燃料失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂的电极为正极,根据总反应,即分析得答案.
解答:
解:(1)图象分析,反应物的能量高于生成物,反应是放热,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的热量计算得到,反应的焓变△H=(a-b)KJ/mol,a<b,所以△H=-(b-a)KJ/mol,反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol;
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol;
(2)在300℃反应开始10min内,甲醇的反应速率=
=0.04mol/L?min,CO的平均反应速率为v(CO)=V(CH3OH)=0.04mol/L?min;
故答案为:0.04mol/L?min;
(3)依据化学平衡三段式列式计算平衡浓度,500°C反应进行到40min反应达到平衡;
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 0.4 0.8
平衡常数K=
=
=25(L/mol)2;
故答案为:25;
(4)在另一体积不变的密闭容器中,充入1.6mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半,依据化学三段式计算,设反应的氢气物质的量为x,则得到:
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L) 1.6 2.0 0
变化量(mol/L) 0.5x x 0.5x
平衡量(mol/L)1.6-0.5x 2.0-x 0.5x
压强之比等于物质的量之比,
=
;
解得:x=1.8mol;
该条件下H2的转化率为=
×100%=90%;
故答案为:90%;
(5)甲醇燃料电池是根据甲醇的燃烧反应来设计的,故反应式2CH3OH+3O2→2CO2+4H2O,由于电解质是固态氧化物,在熔融状态下能传导O2-,故放电时,氧气在正极被还原,电极反应式为:O2-4e-═2O2-,CH3OH在正极发生还原反应,电极反应式为:CH3OH-6e-+3O2-=CO2+2H2O.
通过正极反应可以看出,CH3OH~6e-,故当电路中每流过30mol电子,有 5mol甲醇被完全氧化.
故答案为:5; CH3OH-6e-+3O2-=CO2+2H2O.
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol;
(2)在300℃反应开始10min内,甲醇的反应速率=
| 0.4mol/L |
| 10min |
故答案为:0.04mol/L?min;
(3)依据化学平衡三段式列式计算平衡浓度,500°C反应进行到40min反应达到平衡;
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 0.4 0.8
平衡常数K=
| C(CH3OH) |
| C(CO)?C2(H2) |
| 0.8mol/L |
| 0.2mol/L?(0.4mol/L)2 |
故答案为:25;
(4)在另一体积不变的密闭容器中,充入1.6mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半,依据化学三段式计算,设反应的氢气物质的量为x,则得到:
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L) 1.6 2.0 0
变化量(mol/L) 0.5x x 0.5x
平衡量(mol/L)1.6-0.5x 2.0-x 0.5x
压强之比等于物质的量之比,
| (1.6-0.5x)+(2.0-x)+0.5x |
| 1.6+2 |
| 1 |
| 2 |
解得:x=1.8mol;
该条件下H2的转化率为=
| 1.8 |
| 2.0 |
故答案为:90%;
(5)甲醇燃料电池是根据甲醇的燃烧反应来设计的,故反应式2CH3OH+3O2→2CO2+4H2O,由于电解质是固态氧化物,在熔融状态下能传导O2-,故放电时,氧气在正极被还原,电极反应式为:O2-4e-═2O2-,CH3OH在正极发生还原反应,电极反应式为:CH3OH-6e-+3O2-=CO2+2H2O.
通过正极反应可以看出,CH3OH~6e-,故当电路中每流过30mol电子,有 5mol甲醇被完全氧化.
故答案为:5; CH3OH-6e-+3O2-=CO2+2H2O.
点评:考查热化学方程式、化学平衡的计算和燃料电池电极反应的书写等,是对所学知识的直接运用,难度中等,旨在考查学生对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列排列有错误的是( )
| A、粒子半径:Al3+>Mg2+>Na+>F- |
| B、稳定性:HI<HBr<HCl<HF |
| C、酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| D、碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH |
一般火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述中正确的是( )
| A、分子中碳原子在同一条直线上 |
| B、光照下能够发生取代反应 |
| C、比丁烷更易液化 |
| D、丙烷有两种同分异构体 |
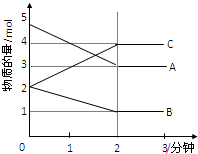 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体). 随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.
随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示. 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: