题目内容
以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图1:

(1)试剂a应选用 (填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、 (填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式: ;
(4)实验室制取气体E的离子方程式是 ,欲对气体E进行干燥和吸收,需选用下列装置(图2)中的 (填写序号);
(5)如何用化学方法检验气体E? .

(1)试剂a应选用
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、
(3)写出步骤Ⅱ中主要反应的化学方程式:
(4)实验室制取气体E的离子方程式是
(5)如何用化学方法检验气体E?
考点:铁盐和亚铁盐的相互转变,电解原理
专题:电化学专题,几种重要的金属及其化合物
分析:(1)铁与盐酸反应生成氯化亚铁;
(2)依据过滤用到的玻璃仪器:漏斗、玻璃棒、烧杯解答;
(3)三氯化铁与铜反应生成氯化亚铁和氯化铜;
(4)实验室用二氧化锰与浓盐酸反应生成氯化锰、水和氯气制备氯气,氯气与浓硫酸不反应,可用浓硫酸干燥,氯气有毒,不能直接排放在空气中,在饱和食盐水中溶解度很小,能与氢氧化钠反应而被吸收;
(5)氯气具有强氧化性能氧化碘化钾生成单质碘,单质碘遇到淀粉变蓝.
(2)依据过滤用到的玻璃仪器:漏斗、玻璃棒、烧杯解答;
(3)三氯化铁与铜反应生成氯化亚铁和氯化铜;
(4)实验室用二氧化锰与浓盐酸反应生成氯化锰、水和氯气制备氯气,氯气与浓硫酸不反应,可用浓硫酸干燥,氯气有毒,不能直接排放在空气中,在饱和食盐水中溶解度很小,能与氢氧化钠反应而被吸收;
(5)氯气具有强氧化性能氧化碘化钾生成单质碘,单质碘遇到淀粉变蓝.
解答:
解:(1)铁与盐酸反应生成氯化亚铁,故答案为:稀盐酸;
(2)过滤用到的玻璃仪器有:漏斗、玻璃棒、烧杯,故答案为:烧杯、玻璃棒;
(3)三氯化铁与铜反应生成氯化亚铁和氯化铜,反应的化学方程式为:2FeCl3+Cu═2FeCl2+CuCl2,故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(4)二氧化锰与浓盐酸反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;氯气与浓硫酸不反应,可用浓硫酸干燥氯气;氯气有毒不能直接排放到空气中,尾气用氢氧化钠吸收;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;②④;
(5)氯气具有强氧化性能氧化碘化钾生成单质碘,单质碘遇到淀粉变蓝,所以将湿润的淀粉KI试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2,
故答案为:将湿润的淀粉KI试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2.
(2)过滤用到的玻璃仪器有:漏斗、玻璃棒、烧杯,故答案为:烧杯、玻璃棒;
(3)三氯化铁与铜反应生成氯化亚铁和氯化铜,反应的化学方程式为:2FeCl3+Cu═2FeCl2+CuCl2,故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(4)二氧化锰与浓盐酸反应的离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(5)氯气具有强氧化性能氧化碘化钾生成单质碘,单质碘遇到淀粉变蓝,所以将湿润的淀粉KI试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2,
故答案为:将湿润的淀粉KI试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2.
点评:本题考查了铁盐、亚铁盐、氯气的性质,题目难度不大,注意不同价态铁元素之间的转化是高考的热点,注意相关知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列互为同位素的是( )
| A、氧气和臭氧 |
| B、氕、氘和氚 |
| C、生石灰和熟石灰 |
| D、钠和钾 |
在密闭容器中进行反应:2A+3B?2C.开始时C的浓度为a mol?L-1,2min后C的浓度变为2a mol?L-1,A和B的物质的量浓度均变为原来的
,则下列说法中不正确的是( )
| 1 |
| 2 |
| A、用B表示的反应速率是0.75a mol/(L?min) |
| B、反应开始时,c(B)=3a mol?L-1 |
| C、反应2min后,c(A)=0.5a mol?L-1 |
| D、反应2min后,c(B)=1.5a mol?L-1 |
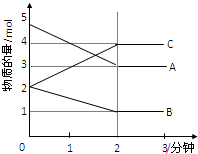 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).