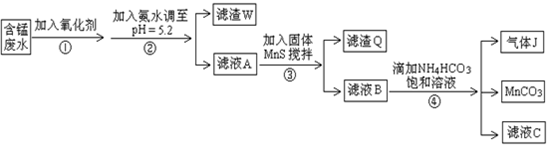
题目内容
2FeCl3+Cu=2FeCl2+CuCl2常用于电子工业制造印刷电路板.某同学为了从腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
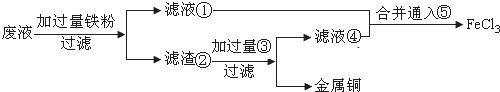
(1)请写出上述实验中加入或生成的有关物质的化学式:
① ③
(2)滤液①和滤液④合并后通入⑤的离子方程式是 .
(3)实验室在配制FeCl3的溶液时,常向其中加入 以抑制其水解.若把FeCl3溶液蒸干,最后得到的固体产物主要是 .

(1)请写出上述实验中加入或生成的有关物质的化学式:
①
(2)滤液①和滤液④合并后通入⑤的离子方程式是
(3)实验室在配制FeCl3的溶液时,常向其中加入
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,加铁可以置换金属铜,可以和三价铁反应,则滤液①为氯化亚铁,滤渣②为Fe和Cu,铜不能盐酸反应,而金属铁可以,加盐酸,过滤滤液④为氯化亚铁,氯气具有氧化性,能将亚铁离子氧化为三价铁;
(1)分析流程结合物质性质和反应现象分析判断;
(2)滤液①和滤液④是氯化亚铁溶液,通入⑤为氯气反应生成氯化铁;
(3)FeCl3水解显酸性,加酸抑制水解;FeCl3溶液在加热时促进Fe3+的水解,水解后生成Fe(OH)3.
(1)分析流程结合物质性质和反应现象分析判断;
(2)滤液①和滤液④是氯化亚铁溶液,通入⑤为氯气反应生成氯化铁;
(3)FeCl3水解显酸性,加酸抑制水解;FeCl3溶液在加热时促进Fe3+的水解,水解后生成Fe(OH)3.
解答:
解:腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,加铁可以置换金属铜,可以和三价铁反应,则滤液①为氯化亚铁,滤渣②为Fe和Cu,铜不能盐酸反应,而金属铁可以,加盐酸,则③为HCl,过滤滤液④为氯化亚铁,氯气具有氧化性,能将亚铁离子氧化为三价铁;
(1)上述分析可知①为FeCl2,③为HCl,故答案为:FeCl2;HCl;
(2)滤液①和滤液④是氯化亚铁溶液,通入⑤为氯气反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(3)FeCl3水解显酸性,加酸抑制水解,所以实验室在配制FeCl3的溶液时,常向其中加入盐酸以抑制其水解;FeCl3溶液在加热时促进Fe3+的水解,水解后生成Fe(OH)3和HCl,HCl挥发,加热蒸干,最终得到Fe(OH)3,故答案为:盐酸;Fe(OH)3.
(1)上述分析可知①为FeCl2,③为HCl,故答案为:FeCl2;HCl;
(2)滤液①和滤液④是氯化亚铁溶液,通入⑤为氯气反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(3)FeCl3水解显酸性,加酸抑制水解,所以实验室在配制FeCl3的溶液时,常向其中加入盐酸以抑制其水解;FeCl3溶液在加热时促进Fe3+的水解,水解后生成Fe(OH)3和HCl,HCl挥发,加热蒸干,最终得到Fe(OH)3,故答案为:盐酸;Fe(OH)3.
点评:本题考查物质的分离提纯实验,为高频考点,涉及铁及其化合物性质的分析等,把握发生的反应、反应现象、物质性质是解题关键,侧重分析与实验能力的考查,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
2013年12月15日,嫦娥三号着陆器与巡视器分离,“玉兔号”巡视器顺利驶抵月球表面.“玉兔”号是中国首辆月球车,成功实现对月面的科学探测.“玉兔”号用
Pu作为热源材料.下列关于
Pu的说法正确的是( )
238 94 |
238 94 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( )

| A、过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤 |
| B、在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2 |
| C、工业上通过电解饱和MgCl2溶液制取金属镁 |
| D、过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
下列卤代烃中,既能发生取代反应又能发生消去反应的是( )
| A、CH3Cl |
| B、CH3CH2CH2Br |
C、 |
D、 |
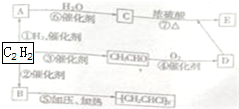 有机物A、B、C、D、E能发生如图所示的转化,其中C、D是生活中常见的有机物,E是具有特殊香味且不溶于水的液体.请回答下面有关问题:
有机物A、B、C、D、E能发生如图所示的转化,其中C、D是生活中常见的有机物,E是具有特殊香味且不溶于水的液体.请回答下面有关问题: