题目内容
19.下列有关性质的比较,不能用元素周期律解释的是( )| A. | 密度:Na>K | B. | 稳定性:HCl>HBr | C. | 还原性:I?>Br? | D. | 碱性:KOH>NaOH |
分析 元素的性质在周期表中出现周期性的变化,由元素的非金属、金属性可比较气态氢化物的稳定性、离子的还原性、最高价氧化物水化物的碱性等,以此来解答.
解答 解:A.周期律与密度无关,则密度大小不能利用元素周期律解释,故A选;
B.由同主族元素的性质变化可知,非金属性Cl>Br,稳定性:HCl>HBr,可利用周期律解释,故B不选;
C.由同主族元素的性质变化可知,非金属性Br>I,还原性:I?>Br?,可利用周期律解释,故C不选;
D.由同主族元素的性质变化可知,金属性K>Na,则碱性:KOH>NaOH,可利用周期律解释,故D不选;
故选A.
点评 本题考查周期表和周期律,为高考常见题型,侧重于学生的分析能力、应用能力的考查,把握同主族元素的性质为解答该类题目的关键,注意元素的性质,题目难度不大.

练习册系列答案
相关题目
9.下列热化学方程式中的△H能表示物质燃烧热的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1 |
10.下列图示实验正确的是( )
| A. | 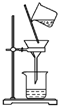 除去粗盐溶液中的不溶物 | B. | 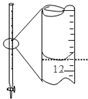 记录滴定终点读数为12.20ml | ||
| C. | 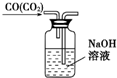 除去CO气体中的CO2气体 | D. | 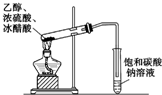 乙酸乙酯制备演示实验 |
7.短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 标准状况下的2.24 LM溶于水,所得溶液pH=13 | |
| C. | YZ2能使湿润的淀粉KI试纸变蓝 | |
| D. | 一定条件下,Cu可与W的最高价氧化物对应水化物发生反应 |
4.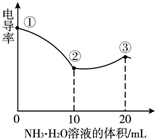 电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
 电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | B. | ②点时溶液的温度最低 | ||
| C. | ③点后离子数目减少电导率略降低 | D. | ③点时溶液中有c ( Cl-)>(CH3COO-) |
11.2.3g某有机物A完全燃烧只生成CO2和水蒸气,生成的气体若通过盛有浓硫酸的洗气瓶后,洗气瓶增重2.7g,若通过装有碱大石灰的干燥管,干燥管增重7.1g.有机物的分子为( )
| A. | C4H12O2 | B. | C3H8O | C. | C2H6O | D. | C2H4 |
8.下列每组物质发生变化所克服的粒子间的作用力属于同种类型的是( )
| A. | 氯化铵受热气化和苯的汽化 | B. | 碘和干冰受热升华 | ||
| C. | 二氧化硅和生石灰的熔化 | D. | 氯化钠和铁的熔化 |
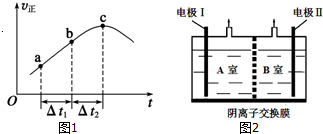
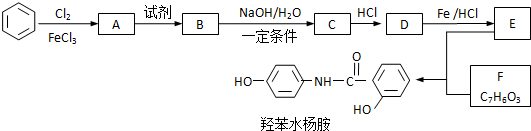
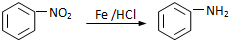
 .
. 、
、 .
.