题目内容
实验室制取氯气的反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应中的氧化剂是 (填写物质的化学式);
(2)8.7g的二氧化锰和足量的浓盐酸反应,制得的氯气在标准状况下的体积为 L.
(3)用200mL 8moL/L的浓盐酸与足量的二氧化锰加热时反应,得到氯气的量 0.4mol(填写“>”、“=”或“<”).
| ||
(1)该反应中的氧化剂是
(2)8.7g的二氧化锰和足量的浓盐酸反应,制得的氯气在标准状况下的体积为
(3)用200mL 8moL/L的浓盐酸与足量的二氧化锰加热时反应,得到氯气的量
考点:氧化还原反应,化学方程式的有关计算
专题:计算题
分析:(1)得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(2)根据二氧化锰和氯气之间的关系式计算氯气的体积;
(3)该反应中部分盐酸作还原剂、部分起酸作用.
(2)根据二氧化锰和氯气之间的关系式计算氯气的体积;
(3)该反应中部分盐酸作还原剂、部分起酸作用.
解答:
解:(1)该反应中氯元素化合价由-1价变为0价、Mn元素化合价由+4价变为+2价,所以HCl作还原剂,MnO2作氧化剂,故答案为:MnO2;
(2)根据MnO2---Cl2↑得生成氯气体积=
×1×22.4L/mol=2.24L,故答案为:2.24;
(3)该反应中盐酸一半起酸作用、一半作还原剂,当浓盐酸浓度降低到一定浓度时变为稀盐酸,稀盐酸和二氧化锰不反应,所以生成氯气的物质的量<
×1=0.4mol,
故答案为:<.
(2)根据MnO2---Cl2↑得生成氯气体积=
| ||
| 1 |
(3)该反应中盐酸一半起酸作用、一半作还原剂,当浓盐酸浓度降低到一定浓度时变为稀盐酸,稀盐酸和二氧化锰不反应,所以生成氯气的物质的量<
| 8mol/L×0.2L |
| 4 |
故答案为:<.
点评:本题考查了氧化还原反应,根据元素化合价变化结合物质之间的反应式来分析解答,易错题是(3),注意浓盐酸和二氧化锰反应能生成氯气,但稀盐酸不能和二氧化锰反应生成氯气,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式正确的是( )
| A、硫酸和氯氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| B、碳酸钠与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O |
| C、铁钉放入硫酸铁溶液中:Fe+Fe3+=2Fe2+ |
| D、Ca(NO3)2溶液和Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
能正确表示下列反应的离子方程式的是( )
| A、氢氧化钡溶液与硫酸反应:H++OH-=H2O |
| B、铁溶于氯化铁溶液:Fe3++Fe=2Fe2+ |
| C、氢氧化钠溶液与硫酸铜溶液反应:2OH-+Cu2+=Cu(OH)2↓ |
| D、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
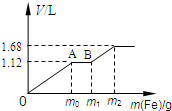 向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )| A、产生氢气的体积为1.68L |
| B、产生二氧化氮的体积为1.12L |
| C、参加反应铁粉的总质量m2=5.6g |
| D、原混合溶液中c(HNO3)=0.5 mol?L-1 |
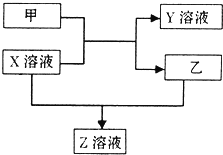 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答: