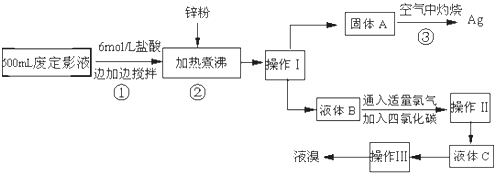
题目内容
在酸性条件下,向含铬废水中加入FeSO4,可将有害的Cr2O72-转化为 Cr3+,然后再加入熟石灰调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去.下列说法正确的是( )
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A、FeSO4可将有害的Cr2O72-转化为 Cr3+,即Cr元素的化合价降低,铁元素的化合价升高;
B、依据离子反应方程式分析;
C、依据得失电子守恒分析;
D、依据化学反应类型分析.
B、依据离子反应方程式分析;
C、依据得失电子守恒分析;
D、依据化学反应类型分析.
解答:
解:A、FeSO4可将有害的Cr2O72-转化为 Cr3+,即Cr元素的化合价降低,铁元素的化合价升高,即FeSO4为还原剂,故A错误;
B、6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,故随着反应的进行,该废水的pH值会增大,故B错误;
C、Cr2O72- 中Cr的化合价为+6价,转化为 Cr3+,即Cr元素的化合价降低6-3,即1molCr得到3mol电子,故转移0.6mole-,则会有0.1molCr2O72- 被还原,故C错误;
D、除去废水中含铬元素离子的过程包括氧化还原反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O和Cr3++3OH-=Cr(OH)3↓(复分解反应),故D正确,故选D.
B、6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,故随着反应的进行,该废水的pH值会增大,故B错误;
C、Cr2O72- 中Cr的化合价为+6价,转化为 Cr3+,即Cr元素的化合价降低6-3,即1molCr得到3mol电子,故转移0.6mole-,则会有0.1molCr2O72- 被还原,故C错误;
D、除去废水中含铬元素离子的过程包括氧化还原反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O和Cr3++3OH-=Cr(OH)3↓(复分解反应),故D正确,故选D.
点评:本题主要考查的知识点是氧化还原反应,利用化合价的变化判断氧化剂与还原剂,依据得失电子守恒计算生成物.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
说明可逆反应A(g)+B(g)?C(g)+D(g)在一定条件下已达到化学平衡状态的事实是.( )
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、A、D的消耗速率相等 |
| D、C、D的生成速率相等 |
下列关于金属钠的说法正确的是( )
| A、.金属钠与氧气反应,条件不同产物不同 |
| B、钠着火时可用水扑灭 |
| C、将钠保存在汽油中 |
| D、金属钠的化学性质活泼,可从硫酸铜溶液中置换出金属铜 |
1体积某气态烃只能与1体积HCl发生加成反应,生成氯代烷.1mol此氯代烷可与5mol氯气发生完全的取代反应,则该烃的结构简式为( )
| A、CH2=CH2 |
| B、CH3CH=CH2 |
| C、CH3CH3 |
| D、CH3CH2CH=CH2 |
向NaBr、NaI、Na2SO3混合液中,通入-定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是( )
| A、NaCl Na2SO4 |
| B、NaCl NaBr Na2SO4 |
| C、NaCl NaBr NaI Na2SO4 |
| D、NaCl NaI Na2SO4 |

 用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:
用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题: