题目内容
(1)将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:2SO2+O2?2SO3△H<0当达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,如图表示: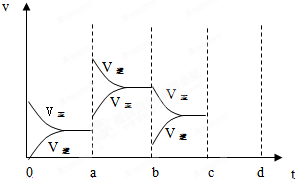
(1)a b过程中改变的条件可能是 ;
(2)b c过程中改变的条件可能是 ;
(3)若增大压强时,反应速度变化情况画在c~d处;
(4)达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L.请计算此条件下的平衡常数和SO2的转化率.(要求写出解题过程)
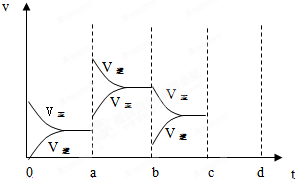
(1)a b过程中改变的条件可能是
(2)b c过程中改变的条件可能是
(3)若增大压强时,反应速度变化情况画在c~d处;
(4)达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L.请计算此条件下的平衡常数和SO2的转化率.(要求写出解题过程)
考点:化学平衡的影响因素,化学平衡的计算
专题:
分析:(1)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断;
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断;
(3)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断画在c~d处;
(4)依据化学平衡三段式列式计算,2SO2(g)+O2(g)?2SO3(g),根据浓度计算式c=
计算平衡浓度,平衡常数等于生成物平衡浓度的幂次方乘积除以反应物的幂次方乘积得到,转化率=
×100%得到.
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断;
(3)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断画在c~d处;
(4)依据化学平衡三段式列式计算,2SO2(g)+O2(g)?2SO3(g),根据浓度计算式c=
| n |
| V |
| 消耗量 |
| 起始量 |
解答:
解:(1)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,故答案为:升高温度;
(2)b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,故答案为:减小SO3浓度;
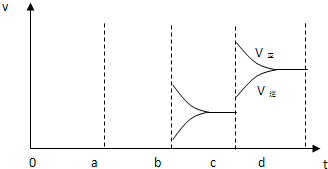
(3)若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为
 ,
,
答: ;
;
(4)二氧化硫消耗物质的量浓度为x,则
2SO2(g)+O2(g)?2SO3(g),
起始量(mol/L) 1 0.5 0
变化量(mol/L) x 0.5x x
平衡量(mol/L) 1-x 0.5-0.5x x
得到x=0.5mol/L,
平衡时各物质的浓度为c(SO2)=0.5 mol?L-1;
c(O2)=0.5mol/L-0.5×0.5mol/L=0.25 mol?L-1;
c(SO3)=0.5 mol?L-1;
所以K=
=4(L/mol),
平衡时SO2的转化率为=
×100%=50%,
答:该温度下的平衡常数4;平衡时SO2的转化率为50%.
(2)b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,故答案为:减小SO3浓度;
(3)若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为
 ,
,答:
 ;
;(4)二氧化硫消耗物质的量浓度为x,则
2SO2(g)+O2(g)?2SO3(g),
起始量(mol/L) 1 0.5 0
变化量(mol/L) x 0.5x x
平衡量(mol/L) 1-x 0.5-0.5x x
得到x=0.5mol/L,
平衡时各物质的浓度为c(SO2)=0.5 mol?L-1;
c(O2)=0.5mol/L-0.5×0.5mol/L=0.25 mol?L-1;
c(SO3)=0.5 mol?L-1;
所以K=
| 0.52 |
| 0.52×0.25 |
平衡时SO2的转化率为=
| 0.5mol/L |
| 1mol/L |
答:该温度下的平衡常数4;平衡时SO2的转化率为50%.
点评:本题考查了化学平衡移动的影响因素,解答本题的关键是正确判断化学方程式的特征,结合外界条件对平衡移动的影响分析图象,和化学平衡三段式的计算方法,主要是反应速率、平衡常数、转化率的计算应用,注意平衡浓度计算平衡常数,题目较简单.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
要提取碘水中的碘单质,所选萃取试剂及说法正确的是( )
| A、用酒精后静置则上层颜色加深 |
| B、用汽油二者混溶不分层 |
| C、用CCl4后静置则上层颜色变浅,下层颜色加深 |
| D、用汽油后静置则上层颜色变浅,下层颜色加深 |
某溶液中仅有5种离子,其中含有4n个Na+,2n个K+,n个Cu2+离子,3n个SO42-,则溶液中NO3-的个数为( )
| A、n | B、2n | C、3n | D、4n |
1.9g AO32-中核外电子数比质子数多3.01×1022个,则元素A的相对原子质量为( )
| A、12 | B、28 | C、32 | D、76 |
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
在酸性条件下,向含铬废水中加入FeSO4,可将有害的Cr2O72-转化为 Cr3+,然后再加入熟石灰调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去.下列说法正确的是( )
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: