题目内容
1体积某气态烃只能与1体积HCl发生加成反应,生成氯代烷.1mol此氯代烷可与5mol氯气发生完全的取代反应,则该烃的结构简式为( )
| A、CH2=CH2 |
| B、CH3CH=CH2 |
| C、CH3CH3 |
| D、CH3CH2CH=CH2 |
考点:有机物结构式的确定
专题:
分析:1体积某气态烃只能与1体积HCl发生加成反应,说明分子中含一个双键,生成的氯代烷,有机物中有几个氢原子被取代,就要消耗几分子的氯气.
解答:
解:1体积某气态烃只能与1体积HCl发生加成反应,说明分子中含一个双键,1mol该加成反应的产物(氯代烷)可与5mol氯气发生完全的取代反应,判断该加成产物分子中只含有5个氢原子,所以原烃分子中含有4个氢原子,则为CH2=CH2.
故选:A.
故选:A.
点评:本题考查学生对有机反应类型中的加成反应和取代反应的理解,难度不大,注意把握常见有机反应.

练习册系列答案
相关题目
在酸性条件下,向含铬废水中加入FeSO4,可将有害的Cr2O72-转化为 Cr3+,然后再加入熟石灰调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去.下列说法正确的是( )
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
一水合氨是一种常见的弱碱,为了证明一水合氨是弱电解质.,某同学开展了题为“一水合氨是弱电解质的实验研究”的探究活动.该同学设计了如下方案,其中错误的是( )
| A、先配制一定量的0.10mol?L-1氨水,然后测溶液的pH,若pH小于13,则可证明一水合氨为弱电解质. |
| B、先分别配制一定量0.01mol?L-1氨水和0.10mol?L-1氨水,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明一水合氨是弱电解质. |
| C、先测0.10mol?L-1 氨水的pH,然后将其加热至100℃,再测pH,如果pH变大则可证明一水合氨是弱电解质. |
| D、配制一定量的NH4Cl溶液.测pH.若常温下pH小于7.则证明一水合氨是弱电解质. |
利用下列实验装置能完成相应实验的是( )

| A、装置①测定化学反应速率 |
| B、装置②制取并吸收HCl |
| C、装置③量取8.5mL的稀硫酸 |
| D、装置④模拟铁的腐蚀 |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).下列分析正确的是( )
| A、CuS的溶解度大于PbS的溶解度 |
| B、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++ZnS→CuS+Zn2+ |
| D、整个过程涉及的反应类型只有氧化还原反应 |
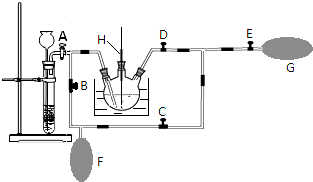
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: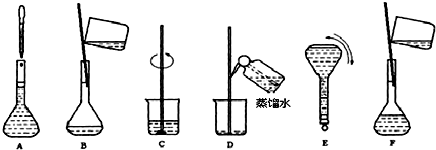
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH 
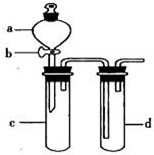 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.