题目内容
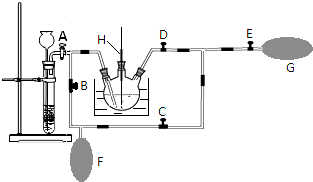
 用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:
用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:(1)图中D装置在实验中的作用是
(2)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是
(3)若A为浓盐酸,B为MnO2,并加热圆底烧瓶,此时发生反应的离子方程式为
考点:实验装置综合
专题:
分析:(1)如生成气体极易溶于C中液体,则D可起到防止倒吸作用;
(2)生成氨气溶于水呈碱性,与氯化铝反应生成氢氧化铝沉淀;
(3)MnO2和浓盐酸反应生成氯气,氯气可置换出碘.
(2)生成氨气溶于水呈碱性,与氯化铝反应生成氢氧化铝沉淀;
(3)MnO2和浓盐酸反应生成氯气,氯气可置换出碘.
解答:
解:(1)如生成气体极易溶于C中液体,则C中液体上升,因C的球形部分体积较大,当C中液体脱离液面时,由于自身重力作用可回落到C中,从而可起到防止倒吸作用,
故答案为:防止倒吸;
(2)生石灰与水反应生成氢氧化钙,反应放出大量的热,可使氨气挥发,生成氨气溶于水呈碱性,且一水合氨为弱碱,则与氯化铝反应生成氢氧化铝沉淀,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:产生白色沉淀;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)若A为浓盐酸,B为MnO2,并加热圆底烧瓶,发生反应生成氯化锰、氯气和水,反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,若C中盛有KI淀粉溶液,旋开E后,氯气可置换出碘,C中发生反应的化学反应方程式为Cl2+2KI=I2+2KCl,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;Cl2+2KI=I2+2KCl.
故答案为:防止倒吸;
(2)生石灰与水反应生成氢氧化钙,反应放出大量的热,可使氨气挥发,生成氨气溶于水呈碱性,且一水合氨为弱碱,则与氯化铝反应生成氢氧化铝沉淀,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:产生白色沉淀;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)若A为浓盐酸,B为MnO2,并加热圆底烧瓶,发生反应生成氯化锰、氯气和水,反应的离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
点评:本题综合考查物质的性质的实验探究,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质,难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )| A、原子半径:Y>Z>W |
| B、一定条件下,Y可置换出X |
| C、气态氢化物稳定性:Z>W |
| D、熔点YW2>XW4 |
下列事实,不能用勒夏特列原理解释的是( )
| A、实验室用排饱和食盐水而不用排水法收集氯气 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D、光照新制的氯水时,溶液中c(H+)增大 |
在酸性条件下,向含铬废水中加入FeSO4,可将有害的Cr2O72-转化为 Cr3+,然后再加入熟石灰调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去.下列说法正确的是( )
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH 
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.