题目内容
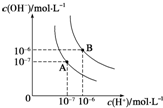 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=(2)25℃时,在0.1L 0.2mol?L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH=
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
考点:离子积常数,水的电离
专题:电离平衡与溶液的pH专题
分析:(1)Kw=c(H+)?c(OH-);温度不同,Kw不同,升温促进水的电离,氢离子浓度增大;水解的盐促进水的电离;
(2)根据pH=-lgc(H+)、电离度=
×100%来计算;
(3)依据电离常数大小分析反应生成产物;
(2)根据pH=-lgc(H+)、电离度=
| 电离出的离子浓度 |
| 原来总浓度 |
(3)依据电离常数大小分析反应生成产物;
解答:
解:(1)25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)?c(OH-)=10-14 ,当温度升高到95℃,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)?c(OH-)=10-12 ;95℃时0.1mol?L-1 的NaOH溶液中Kw=c(H+)?c(OH-)=10-12 ;c(OH-)=0.1mol/L,水电离出的c(H+)=1×10-11;水的电离时吸热过程,加热促进电离氢离子浓度和氢氧根离子浓度增大,Kw增大,所以Kw(25℃)<Kw(95℃); NH4Cl固体溶解后溶液中铵根离子水解生成一水合氨和氢离子,溶液呈酸性,水的电离被促进;
故答案为:1×10-11;<;促进;
(2)在0.1L 0.2mol?L-1的HA溶液中,有0.001mol的HA电离成离子,则c(H+)=
=0.01mol/L,所以pH=2,电离度=
×100%=
×100%=5%,故答案为:2;5%;
(3)向NaCN溶液中通入少量CO2 ,H2CO3酸性大于HCN大于HCO3-,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3;
故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
故答案为:1×10-11;<;促进;
(2)在0.1L 0.2mol?L-1的HA溶液中,有0.001mol的HA电离成离子,则c(H+)=
| 0.001mol |
| 0.1L |
| 电离出的离子浓度 |
| 原来总浓度 |
| 0.001 |
| 0.2 |
(3)向NaCN溶液中通入少量CO2 ,H2CO3酸性大于HCN大于HCO3-,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3;
故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
点评:本题考查了水的电离平衡、水的离子积常数的影响因素以及计算、pH、电离度的计算等知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
同分异构现象是造成有机物种类繁多的重要原因之一.下列各组物质中互为同分异构体的是( )
| A、13C与14C |
| B、CH3CH2OH与CH3COOH |
| C、甲烷与丙烷 |
D、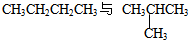 |
下列行为中符合安全要求的是( )
| A、进入煤矿井时,用火把照明 |
| B、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| C、节日期间,在开阔的广场燃放烟花炮竹 |
| D、实验时,将水倒入浓硫酸配制稀硫酸 |
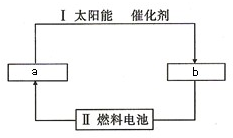 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.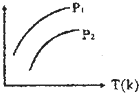 下图表示不同温度(T)和压缩(P)对可逆反应2L(g)?2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是( )
下图表示不同温度(T)和压缩(P)对可逆反应2L(g)?2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是( )