题目内容
 如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
L-1.
(2)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)甲、乙两同学欲用上述浓盐酸和蒸馏水配制250mL物质的量浓度为0.400mol?L-1的稀盐酸.
①每位同学各需要量取
②在配制过程中,甲同学存在以下不正确操作,对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填“偏大”、“偏小”或“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面.
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水.
③乙同学转移溶液时操作如图2所示,其中存在的错误是
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据c=
计算;
(2)B.容量瓶不能用待配溶液润洗;
C.不能在容量瓶中溶解或稀释;
(3)①根据溶液稀释计算公式:c1V1=c2V2计算;
②根据实验操作对c=
的产生的影响进判断;
③配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,配制多大体积的溶液要采用多大体积的容量瓶;
| 1000ρω |
| M |
(2)B.容量瓶不能用待配溶液润洗;
C.不能在容量瓶中溶解或稀释;
(3)①根据溶液稀释计算公式:c1V1=c2V2计算;
②根据实验操作对c=
| n |
| V |
③配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,配制多大体积的溶液要采用多大体积的容量瓶;
解答:
解:(1)质量分数36.5%、密度1.19g/mL 浓盐酸的物质的量浓度=
=11.9mol/L,
故答案为:11.9;
(2)A.使用容量瓶前检验是否漏,故A正确;
B.容量瓶不能用待配溶液润洗,故B错误;
C.不能在容量瓶中溶解或稀释,故C错误;
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故D正确;
故答案为:BC;
(3)①c1V1=c2V2,
11.9mol/L×V1=0.400mol?L-1×0.25L,
所以V1=0.0084L=8.4mL
故答案为:8.4;
②a.用量筒量取浓盐酸时俯视观察凹液面,所浓溶液的体积偏小,所配溶液中溶质的物质的量偏小,所以浓度偏小;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致配制的溶液的体积偏大,溶液浓度偏小,
故答案为:a.偏小 b. 偏小
③配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,故答案为:转移液体时没有用玻璃棒引流;容量瓶用的是100mL,应该用250mL.
| 1000×1.19×36.5% |
| 36.5 |
故答案为:11.9;
(2)A.使用容量瓶前检验是否漏,故A正确;
B.容量瓶不能用待配溶液润洗,故B错误;
C.不能在容量瓶中溶解或稀释,故C错误;
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故D正确;
故答案为:BC;
(3)①c1V1=c2V2,
11.9mol/L×V1=0.400mol?L-1×0.25L,
所以V1=0.0084L=8.4mL
故答案为:8.4;
②a.用量筒量取浓盐酸时俯视观察凹液面,所浓溶液的体积偏小,所配溶液中溶质的物质的量偏小,所以浓度偏小;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致配制的溶液的体积偏大,溶液浓度偏小,
故答案为:a.偏小 b. 偏小
③配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,故答案为:转移液体时没有用玻璃棒引流;容量瓶用的是100mL,应该用250mL.
点评:本题考查了物质的量浓度的有关计算及配置一定物质的量浓度的溶液误差分析,难度不大,要注意配置一定物质的量浓度溶液的误差分析,根据验操作对c=
产生的影响判断,分析变化的物理量,从而确定浓度的变化.
| n |
| V |

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
人体胃酸的主要成分是盐酸.胃酸可助消化食物,但胃酸过多会损伤胃粘膜,使人感觉不适.抗酸药(又称抑酸剂)可以减少胃过过多的胃酸.下列物质不属于抗酸药的是( )
A、阿司匹林(主要成分:)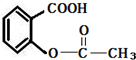 |
| B、胃舒平[主要成分:Al(OH)3] |
| C、碳酸氢钠片(主要成分:NaHCO3) |
| D、胃得乐(主要成分:MgCO3) |
分别向含有下列离子的溶液中加入稀盐酸,原溶液中该离子数目会减少的是( )
| A、SO32- |
| B、SO42- |
| C、Fe3+ |
| D、Ag+ |
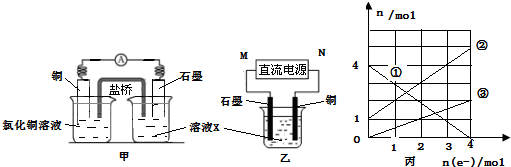
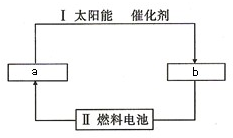 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.