题目内容
6.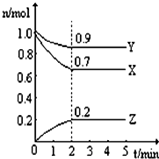 某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,由图中数据分析:(1)该反应的化学方程式Y+3X?2Z.
(2)反应开始至2min,以Z表示的平均反应速率为0.05mol/(L•min).
(3)反应达平衡此时体系的压强是开始时0.9倍.
(4)下列叙述能说明上述反应达到化学平衡状态的是A(填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的密度不随时间的变化而变化.
分析 (1)判断出反应物和生成物,根据物质的量变化之比等于化学计量数之比确定反应的化学方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率;
(3)在相同温度下,气体的物质的量之比等于压强之比;
(4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
解答 解:(1)在反应中,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,相同时间内物质的量的变化比值为:c(Y):c(X):c(Z)=(1.0-0.9):(1.0-0.7):0.2=1:3:2,化学反应中物质的量变化之比等于化学计量数之比,则化学方程式为:Y+3X?2Z;
故答案为:Y+3X?2Z;
(2)反应开始至2min,气体Z的平均反应速率为v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min);
故答案为:0.05mol/(L•min);
(3)反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,在相同温度下,气体的物质的量之比等于压强之比,反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=9:10;
故答案为:0.9;
(4)A、反应前后气体物质的量不同,所以气体物质的量不变,能说明反应达到平衡状态,故A正确;
B、单位时间内每消耗3mol X,同时生成2mol Z,都是正反应,无论是否平衡,其速率之比等于化学计量数之比,不能说明反应达到平衡状态,故B错误;
C、容器体积不变,气体质量不变,密度始终不变,不能说明反应达到平衡状态,故C错误;
故选A.
点评 本题考查化学平衡的变化图象,化学平衡状态的判断,题目难度不大,注意化学方程式的确定方法以及反应速率计算,把握好相关概念和公式的理解及运用.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 铝片和稀硫酸反应 | B. | 灼热的炭与二氧化碳反应 | ||
| C. | 氢氧化钙与氯化铵反应 | D. | 盐酸和氢氧化钠反应 |
| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 向醋酸溶液中加水可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 |
①石油分馏时把温度计插入液面以下
②用溴水除去乙烷中混有的SO2气体
③用乙醇与1mol/L的H2SO4混合共热到170℃制取乙烯
④将苯和溴水混合后加入Fe粉制溴苯
⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
| A. | ①④ | B. | ②⑤ | C. | ②③④⑤ | D. | ①②③④ |
( )
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | M分别和w、X、Y、Z形成化合物,均显相同化合价 | |
| C. | M、X、Z三种元素组成的化合物含有离子键 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
| A. | 阳光通过门缝有光亮通路 | |
| B. | 一支钢笔使两种不同牌号的墨水,容易出现堵塞 | |
| C. | 向氯化铁溶液中加 NaOH溶液,会出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
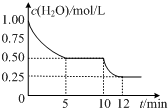 在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )| A. | 0~5min内,v (H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12 min时的K值 | |
| C. | 10 min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v (正)大于11 min 时的v (逆) |
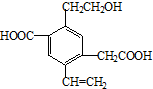
| A. | 该物质在Cu或Ag催化作用下加热,能够被氧化为相应的醛 | |
| B. | 可以用酸性高锰酸钾溶液检验,紫红色褪去,证明其含有碳碳双键 | |
| C. | 1mol该有机物,一定条件下最多可以和4molH2加成 | |
| D. | 该物质消耗Na、NaHCO3、Cu(OH)2的物质的量之比为3:2:1 |
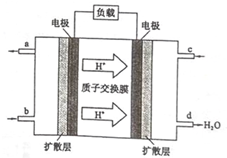 乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.
乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.