题目内容
2.(1)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2SO2 (g)+O2 (g)?2SO3(g)△H<0.甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol.则T1>T2(填“>”“<”),甲容器中反应的平衡常数K=108L•mol-1.(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将1mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g)?2NH3(g),起始时A、B的体积相同均为1L.

①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是d.
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的$\frac{5}{6}$,则平均反应速率v(H2)=$\frac{1}{at}$mol•L-1•S-1.
(3)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为c1=c2<c3 (用c1、c2、c3和>、<、=表示).
分析 (1)该反应为放热反应,温度越高,生成的SO3越少;先利用三段式求出平衡时各物质的浓度,再根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算;
(2)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②已知反应为N2(g)+3H2(g)?2NH3(g),通入1mol N2和3mol H2,达到平衡后容器的压强变为原来的5/6,根据压强之比等于物质的量比结合三段式计算;
(3)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,氨气与硫酸和盐酸恰好反应.
解答 解:(2)该反应为放热反应,温度越高,生成的SO3越少,达到平衡时甲容器中生成的三氧化硫的物质的量少,则甲容器的温度高,即T1>T2;
2SO2 (g)+O2 (g)?2SO3(g)
起始(mol/L):5 3 0
转化(mol/L):x 0.5x x
平衡(mol/L):5-x 3-0.5x x
达到平衡时SO3的物质的量为4.5mol,则x=4.5mol/L,所以K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{4.{5}^{2}}{0.{5}^{2}×0.75}$=108L•mol-1;
故答案为:>;108L•mol-1;
(3)①a.密度=$\frac{总质量}{体积}$,总质量一定,A中体积不变,故密度不变,所以不能说明反应达到平衡状态,故a错误;
b.恒温条件下,平衡常数保持不变,则不能说明反应达到平衡状态,故b错误;
c.都是正反应速率,不能说明反应达到平衡状态,故c错误;
d.N2的转化率先增大,后保持不变,说明反应达到平衡状态,与图象相符,故d正确;
故答案为:d;
②N2(g)+3H2(g)?2NH3(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
达到平衡后容器的压强变为原来的$\frac{5}{6}$,则$\frac{4-2x}{4}$=$\frac{5}{6}$,解得x=$\frac{1}{3}$,
v(H2)=$\frac{\frac{1mol}{aL}}{ts}$=$\frac{1}{at}$mol•L-1•S-1;
故答案为:$\frac{1}{at}$mol•L-1•S-1;
(3)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,铵根离子浓度较大,氨气与硫酸和盐酸恰好反应,所以溶液中铵根离子浓度:c1=c2<c3;
故答案为:c1=c2<c3.
点评 本题考查较综合,涉及平衡常数计算、反应速率计算、平衡状态判断、弱电解质的电离等知识点,这些都是高考高频点,侧重考查学生分析、计算及知识运用能力,注意只有反应前后改变的物理量才能作为平衡状态的判断依据,注意化学平衡常数计算中用物质浓度而不是物质的量计算,这些都是易错点.

 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)再生酸中含有HNO3,采取减压蒸馏的目的为降低蒸馏的温度以减少硝酸的分解.
(2)滤渣1的主要成分为:Fe(OH)3和少量氧化铁.
(3)“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:1:3.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和CaF2.
(6)经检测,最后的残液中c(Ca2+)=0.001mol•L-1,则残液中F-浓度为3.8
Mg•L-1,符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10mg•L-1].
 室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度:a>b,且a点所示溶液中由水电离出的c(OH-)=10-8.7mol/L | |
| C. | pH=7时溶液中c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| D. | b点所示溶液中c(A-)>c(HA) |
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8(mol•L-1)3;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
 +
+ =Fe2O3+5H2O
=Fe2O3+5H2O 向负极迁移
向负极迁移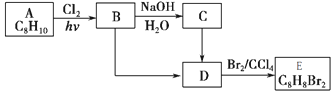
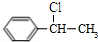 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$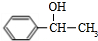 +NaCl
+NaCl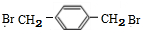 (填结构简式).
(填结构简式).
 .
.