题目内容
10.A~E都是有机化合物,A为一取代芳香烃,B中含有一个甲基.它们的转化关系如图: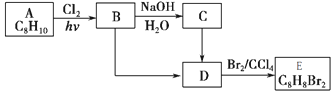
请回答下列问题:
(1)A的名称为乙苯
(2)由B生成C的化学方程式为
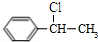 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$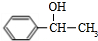 +NaCl
+NaCl(3)由B生成D、由C生成D的反应条件分别是NaOH的醇溶液、加热、浓硫酸、加热.
(4)由A生成B、由D生成E的反应类型分别是取代反应、加成反应.
(5)在E的同分异构体中,苯环上一硝化的产物只有一种的共有7种,其中核磁共振氢谱有两组峰,且峰面积比为1:1的是
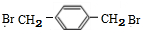 (填结构简式).
(填结构简式).
分析 A分子式为C8H10,为一取代芳香烃,不饱和度为$\frac{2×8+2-10}{2}$=4,则A为苯的同系物,A在光照条件下得到B,B中含有一个甲基,而D能与溴发生加成反应生成E,则D分子中含有1个C=C双键,可知A为 ,B为
,B为 ,B水解生成C为
,B水解生成C为 ,D为
,D为 ,E为
,E为 ,以此来解答.
,以此来解答.
解答 解:(1)A为 ,名称为乙苯,故答案为:乙苯;
,名称为乙苯,故答案为:乙苯;
(2)由B生成C的化学方程式为 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl,
+NaCl,
故答案为: +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl;
+NaCl;
(3) 在NaOH的醇溶液、加热条件下发生消去反应生成
在NaOH的醇溶液、加热条件下发生消去反应生成 ,由C生成D为醇的消去反应,反应条件为浓硫酸、加热,
,由C生成D为醇的消去反应,反应条件为浓硫酸、加热,
故答案为:NaOH的醇溶液、加热;浓硫酸、加热;
(4)由A生成B为光照下的取代反应、由D生成E为碳碳双键发生的加成反应,
故答案为:取代反应;加成反应;
(5)E为 ,在E的同分异构体中,苯环上一硝化的产物只有一种,若有2个侧链,为-CH2Br,处于对位位置,不可能有3个取代基,若为4个取代基,为2个-Br、2个-CH3,有如下位置关系:4个取代基相邻时,2个Br原子位于2个甲基之间,或者2个甲基位于2个Br原子之间,当两两相邻时,2个Br原子相邻、另外2个甲基相邻,或者是甲基与Br原子相邻且Br原子与另外的甲基处于间位,当3个取代基相邻时,甲基位于2个Br原子中间且2个甲基处于对位位置,或溴原子处于2个甲基之间且2个Br原子处于对位位置,故符合条件的同分异构体有7种,其中只有两种氢原子而且H原子数之比为1:1的物质结构简式是
,在E的同分异构体中,苯环上一硝化的产物只有一种,若有2个侧链,为-CH2Br,处于对位位置,不可能有3个取代基,若为4个取代基,为2个-Br、2个-CH3,有如下位置关系:4个取代基相邻时,2个Br原子位于2个甲基之间,或者2个甲基位于2个Br原子之间,当两两相邻时,2个Br原子相邻、另外2个甲基相邻,或者是甲基与Br原子相邻且Br原子与另外的甲基处于间位,当3个取代基相邻时,甲基位于2个Br原子中间且2个甲基处于对位位置,或溴原子处于2个甲基之间且2个Br原子处于对位位置,故符合条件的同分异构体有7种,其中只有两种氢原子而且H原子数之比为1:1的物质结构简式是 ,
,
故答案为:7; .
.
点评 本题考查有机物的推断及合成,为高频考点,把握有机物的结构、官能团变化、碳链变化为解答的关键,侧重分析与推断能力的考查,注意(5)为解答的难点,题目难度不大.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案(1)实验室利用反应2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑可制备氧气.
①取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示.
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异.
实验中可以表明该反应速率差异的现象是产生气泡的快慢.
②实验室用MnO2做该反应的催化剂,使用如图所示装置的A部分制备O2,避免反应过于剧烈的操作是旋转分液漏斗的活塞,控制滴加H2O2溶液的速率.

(2)利用图(a)和(b)中的信息,按图(c)装置(连能的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动


| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
| A. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| B. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 纤维素、甘油分别在浓硫酸存在时与浓硝酸的反应属于同一类型的反应 | |
| D. | 乙醇、乙酸和苯酚的分子中均含有官能团-OH,所以均能与NaOH溶液反应 |
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |

已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+.②部分金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀的pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全的pH | 3.2 | 5.2 | 8.0 |
(1)烧结时ZrSiO4发生反应的化学方程式为ZrSiO4+2Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2ZrO3+Na2SiO3+2CO2↑;滤渣I的化学式为H2SiO3(或H4SiO4).
(2)调节pH=a 的目的是完全沉淀Fe3+、Al3+,而ZrO2+不沉淀;用氨水调节pH=b后发生反应的离子方程式为ZrO2++2NH3•H2O+H2O=Zr(OH)4↓+2NH4+.
(3)以滤渣 II为主要原料制取铁红,请简述实验方法在滤渣 II中加足量NaOH溶液充分反应,过滤、洗净、干燥、加热分解.
(4)工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:3ZrO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Zr+2Al2O3.
(5)一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入甲烷,写出负极的电极反应式为CH4-8e-+4O2-=CO2+2H2O.
