题目内容
NaHCO3溶液中所含有的分子和离子有( )
①NaHCO3 ②H2O ③H2CO3 ④HCO3- ⑤H+ ⑥OH-⑦CO32-.
①NaHCO3 ②H2O ③H2CO3 ④HCO3- ⑤H+ ⑥OH-⑦CO32-.
| A、①②③ |
| B、②④⑤⑥ |
| C、②③④⑤⑥⑦ |
| D、①②③④⑤⑥⑦ |
考点:电解质在水溶液中的电离
专题:
分析:NaHCO3是强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,碳酸氢根离子存在电离和水解平衡,据此确定存在的微粒.
解答:
解:NaHCO3是强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,碳酸氢根离子存在电离和水解平衡,存在H2O、H2CO3、HCO3-、H+、OH-、CO32-.
故选C.
故选C.
点评:本题考查学生电解质的电离以及弱离子的水解和弱酸阴离子的电离平衡等知识,难度不大.

练习册系列答案
相关题目
如图是10mL量筒的一部分,数字XY之间相差2mL若X=6,则量筒所盛液体的体积是( )
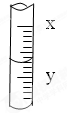

| A、4.30mL |
| B、4.6mL |
| C、4.3mL |
| D、4.60mL |
已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )
| A、X的能量一定高于M |
| B、因该反应为放热反应,故不必加热就可发生 |
| C、Y的能量一定高于N |
| D、X和Y的总能量一定高于M和N的总能量 |
下列说法中错误的是( )
| A、同一原子中一定没有能量相同的电子 |
| B、6C的电子排布式1s22s22px2违反了洪特规则 |
| C、电子排布式1s22s22p63s23p63d3违反了能量最低原理 |
| D、电子排布式1s22s22p63s23p10违反了泡利原理 |
下列说法中正确的是( )
| A、将58.5 g NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,所得溶液的浓度为1 mol/L |
| C、配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D、中和100 g 19.6%的H2SO4溶液,需要NaOH 4 g |
小明体检的血液化验单中,葡萄糖为5.8mmol/L.表示该体检指标的物理量是( )
| A、质量分数 | B、溶解度 |
| C、物质的量浓度 | D、摩尔质量 |
无土栽培技术研究配制一种营养液,此1L营养液中含0.5molNH4Cl、0.16molKCl、0.24molK2SO4.若用KCl、NH4Cl和(NH4)2SO4三种固体来配制,则每升溶液中需三种固体的物质的量依次为( )
| A、0.32mol、0.5mol、0.12mol |
| B、0.02mol、0.64mol、0.24mol |
| C、0.64mol、0.02mol、0.24mol |
| D、0.16mol、0.5mol、0.24mol |
下列指定反应的离子方程式正确的是( )
| A、向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||||
| B、FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | ||||
D、用惰性电极电解氯化钠溶液:2Cl-+2H+
|