题目内容
6.一定量的CuS和Cu2S的混合物投入一定浓度的足量的HNO3中,收集到体积比为1:1的NO和NO2混合气,向反应后的溶液中加入足量NaOH溶液,产生蓝色沉淀、过滤、洗涤、灼烧,得到12.0g CuO,则上述混合气体在标准状况下的体积可能是( )| A. | 8.2L | B. | 11.5L | C. | 15.7L | D. | 16.8L |
分析 利用极限法解答:假设混合物全为CuS,或混合物全为Cu2S,根据n=$\frac{m}{M}$计算出n(CuO),利用原子守恒计算出n(CuS)、n(Cu2S),再根据电子守恒计算出n(NO)、n(NO2),然后根据V=nVm计算出混合气体体积,实际的气体体积介于二者之间.
解答 解:①若混合物全是CuS,其物质的量n(CuS)=n(CuO)=$\frac{12g}{80g/mol}$=0.15mol,转移电子物质的量=0.15×(6+2)=1.2mol,NO和NO2的体积相等,
设NO的物质的量为x、NO2的物质的量为x,
则:3x+x=1.2,
解得:x=0.3,
则生成混合气体的体积为:0.6mol×22.4L/mol=13.44L;
②若混合物全是Cu2S,其物质的量n(Cu2S)=$\frac{1}{2}$n(CuO)=$\frac{1}{2}$×0.15mol=0.075mol,转移电子物质的量为:0.075×10=0.75mol,
设NO为xmol、NO2为xmol,3x+x=0.75,
解得:x=0.1875,
生成气体体积为:0.1875mol×2×22.4L/mol=8.4L,
由于是CuS和Cu2S的混合,则生成的气体体积介于8.4L~13.44L之间,满足条件的为B,
故选B.
点评 本题考查化合物反应的计算、氧化还原反应的计算,题目难度中等,注意掌握守恒思想与极限法的利用,试题侧重对学生综合能力的考查,有利于提高学生的化学计算能力.

练习册系列答案
 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
16.能表示人体大量喝水时,胃液的pH变化的是( )
| A. |  | B. |  | C. |  | D. |  |
17.实现下列变化,需要加入氧化剂的是( )
| A. | NH3→NO | B. | HCl→H2 | C. | NaCl→AgCl | D. | Fe3+→Fe2+ |
14.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是( )
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 灯泡最暗时溶液中无自由移动的离子 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
1.氯化碘(ICl)的化学性质与氯气相似,预计它与水能反应,则下列说法正确的是( )
| A. | 生成物是HI和HClO | B. | 生成物是HCl和HIO | ||
| C. | 属于置换反应 | D. | 属于复分解反应 |
11.下列化学用语中错误的是( )
| A. | CH4分子的比例模型: | B. | 异丁烷的结构简式: | ||
| C. | 乙烷的最简式:CH3 | D. | 乙烯的结构式: |
6.下列说法正确的是( )
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 没有氧元素参加的反应一定不是氧化还原反应 |
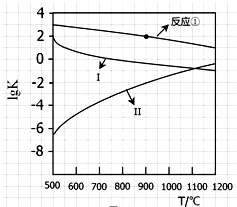 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.