题目内容
根据表中烃的含氧衍生物分子式排列规律,空格中烃的含氧衍生物的有关判断正确的是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH2O2 | C2H4O | C3H6O2 | C4H8O | C6H12O | C7H14O2 | C8H16O |
| A、能与NaHCO3反应的同分异构体有3种 |
| B、该物质肯定能发生加成反应和取代反应 |
| C、1mol符合该分子式的一种有机物与足量Na反应能生成1mol H2,则该物质中一定存在一条碳碳双键 |
| D、该物质与丁烷以任意物质的量比混合时,只要混合物的物质的量一定,消耗的氧气量也一定 |
考点:烃的衍生物官能团,同分异构现象和同分异构体
专题:同分异构体的类型及其判定,有机物分子组成通式的应用规律
分析:根据表中烃的含氧衍生物分子式排列规律,碳原子数目与序号一致,氢原子为序号的2倍,序号为单号时氧原子为2,序号为双号时氧原子为数为1,据此可以判断出序号为5的有机物的分子式为C5H10O2,再结合同分异构体、有机物结构与性质进行判断即可.
解答:
解:根据表中排列顺序可知,C原子数目与对应的序号一致,含有的H原子数为对应序号的2倍,序号为奇数时O原子为2,序号偶数双号时O原子为数为1,据此可以判断出序号为5的有机物的分子式为:C5H10O2,
A.能与NaHCO3反应的同分异构体中含有羧基-COOH,该有机物为戊酸,由于丁基的同分异构体有4种,则戊酸的同分异构体也有4种,故A错误;
B.分子式为C5H10O2的有机物可能为戊酸,戊酸不能发生加成反应,故B错误;
C.1mol符合该分子式的一种有机物与足量Na反应能生成1molH2,生成1mol氢气需要消耗2mol羟基,说明该有机物分子中含有2个羟基,根据分子式C5H10O2可知,该有机物的不饱和度为1,可能含有碳碳双键,有可能含有一个环,故C错误;
D.分子式C5H10O2可以改写为:C4H10?CO2,该有机物完全燃烧时消耗氧气的元素C4H10,与丁烷的分子组成相同,所以该物质与丁烷以任意物质的量比混合时,只要混合物的物质的量一定,消耗的氧气量也一定,故D正确;
故选D.
A.能与NaHCO3反应的同分异构体中含有羧基-COOH,该有机物为戊酸,由于丁基的同分异构体有4种,则戊酸的同分异构体也有4种,故A错误;
B.分子式为C5H10O2的有机物可能为戊酸,戊酸不能发生加成反应,故B错误;
C.1mol符合该分子式的一种有机物与足量Na反应能生成1molH2,生成1mol氢气需要消耗2mol羟基,说明该有机物分子中含有2个羟基,根据分子式C5H10O2可知,该有机物的不饱和度为1,可能含有碳碳双键,有可能含有一个环,故C错误;
D.分子式C5H10O2可以改写为:C4H10?CO2,该有机物完全燃烧时消耗氧气的元素C4H10,与丁烷的分子组成相同,所以该物质与丁烷以任意物质的量比混合时,只要混合物的物质的量一定,消耗的氧气量也一定,故D正确;
故选D.
点评:本题考查了同分异构体的求算、有机物分子式的确定、有机物结构与性质,题目难度中等,根据表中排列规律找出该有机物的分子式为解答本题的关键,注意掌握常见有机物结构与性质及书写同分异构体的方法.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
电子表所用电源常为微型银锌原电池,其电极为A2O和Zn,电解质溶液为KOH溶液,其电极反应分别为:Zn-2e-+2OH-=Zn(OH)2,Ag2O+H2O+2e-=Ag+2OH-,下列叙述正确的是( )
| A、Zn为正极,Ag2O为负极 |
| B、放电时,电池负极附近溶液的pH变大 |
| C、放电时,溶液中阴离子向Zn极方向移动 |
| D、放电时,电流由Zn极经外电路流向Ag2O极 |
某有机物的结构简式如图,该物质1mol与足量的NaOH溶液反应,消耗NaOH的物质的量为( )
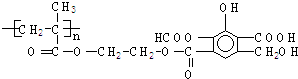
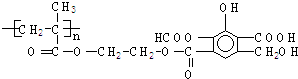
| A、5 mol |
| B、6 mol |
| C、5n mol |
| D、6n mol. |
将一定量下列溶液混合后加热蒸干并灼烧,所得固体不可能为纯净物的是( )
| A、FeCl3与FeCl2 |
| B、KHCO3与KOH |
| C、NH4Cl与NaCl |
| D、AlCl3与Al2(SO4)3 |
柠檬烯是一种食用香料,其结构简式如图, 有关柠檬烯的分析不正确的是( )
有关柠檬烯的分析不正确的是( )
 有关柠檬烯的分析不正确的是( )
有关柠檬烯的分析不正确的是( )| A、柠檬烯的核磁图谱中能出现8个峰 |
| B、柠檬烯的同分异构体中属于芳香族的有12种 |
| C、柠檬烯的分子中所有的碳原子不可能在同一个平面上 |
| D、在一定条件下,柠檬烯可以发生加成、氧化、加聚等反应 |
根据下表信息,判断以下叙述正确的是( )
表:部分短周期元素的原子半径及主要化合价
表:部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、M、Q元素的金属性 L<M |
| C、工业上通过电解L与T形成的化合物生产单质L |
| D、离子半径:R2->T2->L2+>M3+ |
下列说法正确的是( )
| A、1mol CO和1mol N2所含分子数相等,质量相等,它们所占的体积也相等 |
| B、22.4L H2和71g Cl2恰好反应生成2mol HCl |
| C、非标准状况下,1mol气体的体积有可能是22.4L |
| D、1mol HCl和1mol H2O在标准状况下的体积都约是22.4L |
下列说法一定正确的是( )
| A、周期表中同主族元素单质的熔点从上到下逐渐增高 |
| B、16g石墨与8g CH4所含共价键数目相等 |
| C、钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
| D、若将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到AlCl3和Na2SO3 |