题目内容
15.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白.过氧化氢法生产亚氯酸钠的流程图如下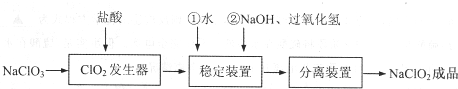
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在稳定装置中生成NaClO2,H2O2作B(选填序号).
A.氧化剂 B.还原剂 C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.
(3)在实验室模拟“固体分离装置”中的技术(即从溶液中分离出溶质),必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却 F.萃取
(4)经查阅资料知道:①当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
②溶液中能发生反应:2S2O32-+I2=2I-+S4O62-.
欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取NaClO2样品Wg,加水配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol•L-1的 Na2S2O3溶液滴定 |
②步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×10{\;}^{-2}VC}{4W}$(用有关字母表示).
(5)ClO2是新型饮用水消毒剂,Cl2常用于饮用水消毒.等物质的量的物质,ClO2的消毒效率是Cl2的2.5倍.
分析 (1)NaClO3和HCl反应,生成ClO2,可以写出方程式,并用化合价升降法配平得到;
(2)在NaClO2稳定装置中,加入过氧化氢是还原高价的氯的化合物,得到NaClO2,双氧水被氧化成氧气;
(3)溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤得到;
(4)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6;
②溶液颜色蓝色变化为无色分析判断反应终点;依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到样品中NaClO2的质量分数;
(5)ClO2和Cl2用于消毒时,都被还原为Cl-,根据电子得失守恒可计算出ClO2的消毒效率与Cl2的消毒效率的关系.
解答 解:(1)NaClO3和盐酸发生氧化还原反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,
故答案为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O;
(2)适当条件下可结晶析出NaClO3•3H2O,在NaClO2稳定装置中,H2O2作还原剂,还原NaClO3为NaClO2,故选B,反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2,
故答案为:B;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 ;
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤,
故答案为:BEA;
(4)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6,
故答案为:ClO2-+4H++4I-=2I2+Cl-+2H2O;
②溶液颜色蓝色变化为无色分析判断反应终点,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化,
依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,设NaClO2的物质的量为x,
ClO2-~2I2~4Na2S2O3
1 4
x cV×10-3mol
x=$\frac{cV×10{\;}^{-3}}{4}$,
样品中NaClO2的质量分数=$\frac{\frac{cV×1{0}^{-3}}{4}mol×90.5g/mol}{Wg}$×100%=$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%,
故答案为:滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化;$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%;
(5)ClO2和Cl2用于消毒时,都被还原为Cl-,则有关系式ClO2~5e-,Cl2~2e-,等物质的量的ClO2和Cl2转移电子的物质的量之比为5:2=2.5,所以等物质的量的物质,ClO2的消毒效率是Cl2的2.5倍,
故答案为:2.5.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大.

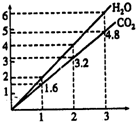 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )| A. | 一定含有CH4 | B. | 一定含有C2H6 | C. | 一定含有C2H4 | D. | 一定不含有C3H4 |
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | EGCG在空气中易氧化,也能与溴水发生加成反应 | |
| C. | 1molEGCG最多可与含9mol氢氧化钠的溶液完全作用 | |
| D. | EGCG能与碳酸钠溶液反应,但不能放出二氧化碳 |
| A. | 原子序数:A大于B | B. | A和B可能在同一主族 | ||
| C. | A可能在第2周期ⅣA族 | D. | A肯定是金属元素 |
 2008年北京残奥会吉祥物是“福牛乐乐”(Fumulele).有一种有机物的键线式也酷似牛.故称为牛式二烯炔醇(eowenynenyno1)
2008年北京残奥会吉祥物是“福牛乐乐”(Fumulele).有一种有机物的键线式也酷似牛.故称为牛式二烯炔醇(eowenynenyno1)

 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: