题目内容
5.一定温度下,某密闭容器里发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,当反应达到平衡时,测得容器中各物质的物质的量均为 n mol.欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )①升高温度 ②增大压强
③再通入n mol CO2和n mol H2 ④再加入2n mol CO和2n mol H2O(g)
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①②③ |
分析 该反应是一个反应前后气体体积不变、放热的可逆的化学反应,根据题中信息知,该反应初始,相当于向容器中加入2nmol一氧化碳和2nmol水,一氧化碳和水的转化率都是50%,根据外界条件对化学平衡的影响和等效平衡分析.
解答 解:①升高温度,平衡向着逆向移动,氢气的物质的量减小,故错误;
②增大压强,平衡不移动,但体积减小,所以氢气的物质的量浓度可能增大1倍,故正确;
③再通入n mol CO2和n mol H2 平衡向逆反应方向移动,有部分氢气减少,所以氢气的物质的量浓度不可能是增大1倍,故错误;
④再加入2n mol CO和2n mol H2O(g)平衡向正反应方向移动,当再次达到平衡状态时,氢气的物质的量浓度能增大1倍,故正确;
故选:B.
点评 本题考查了外界条件对化学平衡的影响,难度不大,易错选项是B,虽然该反应是一个气体体积不变的化学反应,增大压强平衡不移动,但增大压强缩小容器的体积仍能使氢气的浓度增大1倍.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白.过氧化氢法生产亚氯酸钠的流程图如下
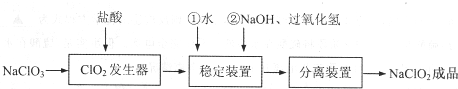
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在稳定装置中生成NaClO2,H2O2作B(选填序号).
A.氧化剂 B.还原剂 C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.
(3)在实验室模拟“固体分离装置”中的技术(即从溶液中分离出溶质),必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却 F.萃取
(4)经查阅资料知道:①当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
②溶液中能发生反应:2S2O32-+I2=2I-+S4O62-.
欲测定成品中NaClO2的含量,现进行如下操作:
①步骤Ⅱ中发生反应的离子方程式是ClO2-+4H++4I-=2I2+Cl-+2H2O,
②步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×10{\;}^{-2}VC}{4W}$(用有关字母表示).
(5)ClO2是新型饮用水消毒剂,Cl2常用于饮用水消毒.等物质的量的物质,ClO2的消毒效率是Cl2的2.5倍.

已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在稳定装置中生成NaClO2,H2O2作B(选填序号).
A.氧化剂 B.还原剂 C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.
(3)在实验室模拟“固体分离装置”中的技术(即从溶液中分离出溶质),必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却 F.萃取
(4)经查阅资料知道:①当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
②溶液中能发生反应:2S2O32-+I2=2I-+S4O62-.
欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取NaClO2样品Wg,加水配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol•L-1的 Na2S2O3溶液滴定 |
②步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×10{\;}^{-2}VC}{4W}$(用有关字母表示).
(5)ClO2是新型饮用水消毒剂,Cl2常用于饮用水消毒.等物质的量的物质,ClO2的消毒效率是Cl2的2.5倍.
16.已知25℃时,电离平衡常数Ka(HF)=3.6×10-4 mol/L,溶度积常数Ksp(CaF2)=1.46×10-10 mol3/L3.现向1L 0.2mol/L HF溶液中加入1L 0.2mol•L-1 CaCl2溶液,则下列说法中,正确的是( )
| A. | 25℃时,0.1 mol/L HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中,Ksp(CaF2)=$\frac{1}{{K}_{a}HF}$ | |
| D. | 该体系中有CaF2沉淀产生 |
13.下列电子式或结构式正确的是( )
| A. | HCl  | B. | NaCl  | C. | HClO H-Cl-O | D. | CO2 O=C=O |
20.在N2(g)+3H2(g)═2NH3(g)的反应中,在5s中N2由6mol/L减至2mol/L,则NH3的平均反应速率是( )
| A. | 0.08 mol/(L•s) | B. | 0.8 mol/(L•s) | C. | 1.6mol/(L•s) | D. | 2.4 mol/(L•s) |
10.一元强酸和一元强碱恰好完全中和时,它们一定相等的是( )
| A. | 体积 | B. | 质量 | ||
| C. | 物质的量浓度 | D. | H+和OH-的物质的量 |
17.已知一种c(H+)=1×10-3mol•L-1的酸和一种c(OH-)=1×10-3mol•L-1的碱溶液等体积混合后,溶液呈酸性,其原因可能是( )
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等浓度的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |
15.在0.1mol/L的醋酸溶液中加水稀释或加入少量醋酸钠晶体,都会引起( )
| A. | pH增加 | B. | CH3COOH电离程度增大 | ||
| C. | 导电能力减弱 | D. | c(OH-) 减小 |