题目内容
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)为 mol?L-1.
考点:化学方程式的有关计算,物质的量浓度的相关计算
专题:计算题
分析:由BaCl2和稀硫酸反应可计算Ba2+离子的物质的量,利用NaCl和AgNO3溶液反应计算出Cl-离子的物质的量,由混合液呈电中性可计算出钠离子的物质的量,并注意均分成两份及计算原混合溶液中的c(Na+)来解答即可.
解答:
解:设每份中的Ba2+离子的物质的量为m,Cl-离子的物质的量为n,
由Ba2++SO42-═BaSO4↓
1 1
m xmol
=
解得:m=xmol,
Cl-+Ag+═AgCl↓
1 1
n ymol
=
解得:n=ymol,
设每份中的钠离子的物质的量为z,BaCl2和NaCl的混合溶液不显电性,
则x×2+z=y,z=(y-2x)mol,则原溶液中的钠离子为(y-2x)mol×2=(2y-4x)mol,
c(Na+)=
=
mol/L,
故答案为:
;
由Ba2++SO42-═BaSO4↓
1 1
m xmol
| 1 |
| m |
| 1 |
| x |
Cl-+Ag+═AgCl↓
1 1
n ymol
| 1 |
| n |
| 1 |
| y |
设每份中的钠离子的物质的量为z,BaCl2和NaCl的混合溶液不显电性,
则x×2+z=y,z=(y-2x)mol,则原溶液中的钠离子为(y-2x)mol×2=(2y-4x)mol,
c(Na+)=
| (2y-4x)mol |
| aL |
| 2y-4x |
| a |
故答案为:
| 2y-4x |
| a |
点评:本题考查学生利用离子反应方程式的计算,明确离子之间的量的关系即可解答,利用溶液不显电性来计算钠离子的物质的量是解答的关键,并注意两等份的关系,题目难度中等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
一定能在下列溶液中大量共存的离子组是( )
| A、能使pH试纸变深蓝色的溶液中,Na+、AlO2-、S2-、CO32- |
| B、由水电离产生的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、HCO3- |
| C、含有大量Fe3+的溶液,SCN-、I-、K+、Br- |
| D、澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42- |
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O+?CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
CH3COOH?CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O+?CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A、混合溶液PH<7 |
| B、对混合溶液进行微热,K1增大、K2减小 |
| C、调节混合溶液的PH值至中性,则此时溶液中c(Na+)═c(CH3COO-) |
| D、温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
研究发现,空气中少量的NO2能作为催化剂参与硫酸型酸雨的形成,NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
| A、硫化氢通入浓H2SO4中 |
| B、稀H2SO4和乙酸乙酯共热 |
| C、浓H2SO4和C2H5OH共热到170℃ |
| D、潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
下列物质属于含有共价键的离子化合物的是( )
| A、SiO2 |
| B、Na2O |
| C、Ca(OH)2 |
| D、H2SO4 |
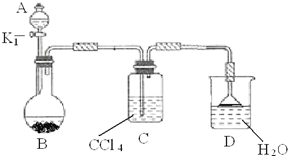 以下为苯的取代反应的探究实验.
以下为苯的取代反应的探究实验.