题目内容
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ?mol-1 △S=+133.7kJ?mol-1?k-1
该反应能否自发进行与 有关.
(2)该反应的平衡常数表达式为K= .
(3)升高温度,其平衡常数 (填”增大”“减小”或”不变”).
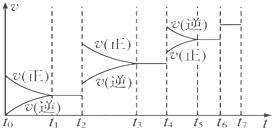
(4)达到平衡后,改变某一外界条件(不改变H2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 .
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ?mol-1 △S=+133.7kJ?mol-1?k-1
该反应能否自发进行与
(2)该反应的平衡常数表达式为K=
(3)升高温度,其平衡常数
(4)达到平衡后,改变某一外界条件(不改变H2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是

考点:化学平衡的影响因素,焓变和熵变,化学平衡常数的含义
专题:
分析:(1)①根据△G=△H-T△S判断,△G<0,反应自发进行;
(2)依据化学方程式和平衡常数概念书写;
(3)依据反应是吸热反应,升温平衡向吸热反应方向进行分析;
(4)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高.
(2)依据化学方程式和平衡常数概念书写;
(3)依据反应是吸热反应,升温平衡向吸热反应方向进行分析;
(4)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高.
解答:
解:(1)①由热化学反应方程式可知,反应为焓增,熵增过程,即△H>0、△S>0,△G=△H-T△S<0反应自发进行,所以该反应自发进行,受温度影响,298℃时,△H=+131.3kJ?mol-1△S=+133.7J?mol-1?K-1,△G=△H-T△S=+131.3kJ?mol-1-(298+273)K×(+133.7×10-3KJ?mol-1)?K-1=54.96KJ/mol>0,说明反应非自发进行;
故答案为:温度;
(2)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,固体不能写入平衡常数表达式,反应的平衡常数为:K=
,故答案为:
;
(3)反应是吸热反应,升温平衡正向进行,平衡常数增大,故答案为:增大;
(4)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
故答案为:增大压强;t3---t4.
故答案为:温度;
(2)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,固体不能写入平衡常数表达式,反应的平衡常数为:K=
| [CO]?[H2] |
| [H2O] |
| [CO]?[H2] |
| [H2O] |
(3)反应是吸热反应,升温平衡正向进行,平衡常数增大,故答案为:增大;
(4)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
故答案为:增大压强;t3---t4.
点评:本题考查化学平衡常数与影响因素、影响平衡移动的因素与平衡图象等,比较基础,注意方程式中物质的状态,理解外界条件对反应速率的影响,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
实验室进行下列实验时,温度计水银球置于反应物液面以下的是( )
| A、乙醇和浓硫酸混合加热,制乙烯 |
| B、从石油中提炼汽油 |
| C、用蒸馏方法提纯水 |
| D、实验室制取溴苯 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图示的是( )

| A、CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g);△H<0 |
| B、2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g)+2H2O(g);△H<0 |
| C、CH3CH2OH(g) CH2=CH2(g)+H2O(g);△H>0 |
| D、CO2(g)+H2(g) CO(g)+H2O(g);△H>0 |
对于平衡体系mA(g)+nB(g)?pC(g)+qD(g);△H<0.下列结论中不正确的是( )
| A、若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小 |
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
已知某温度下CH3COOH和NH3?H2O的电离常数相等,现向10mL浓度为0.1mol?L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||||
| B、当加入氨水的体积为10 mL时c(NH4+)=c(CH3COO-) | ||||
| C、水的电离程度始终增大 | ||||
D、
|
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、X2为0.2 mol?L-1 |
| B、Y2为0.2 mol?L-1 |
| C、Z为0.3 mol?L-1 |
| D、Z为0.45 mol?L-1 |